
一定条件下,在密闭容器中,能表示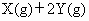
 反应一定达到化学平衡状态的是
反应一定达到化学平衡状态的是
[ ]
①X、Y、Z的物质的量之比为1∶2∶2
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成nmolZ,同时生成2nmolY
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
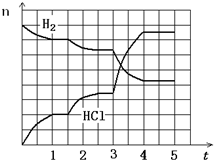 (2013?河东区一模)工业上高纯硅可以通过下列反应制取:
(2013?河东区一模)工业上高纯硅可以通过下列反应制取:| 高温 |
| c4(HCl) |
| c(SiCl4)?c2(H2) |
| c4(HCl) |
| c(SiCl4)?c2(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温 |
| c12(HCl) |
| c3(SiCl4)c2(N2)c6(H2) |
| c12(HCl) |
| c3(SiCl4)c2(N2)c6(H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省九江市七校高三第二次联考化学试卷(解析版) 题型:填空题
氮气及含氮的化合物在国民经济中占有重要地位。合成氨工业中,合成塔中每产生2 mol NH3,放出92.4 kJ热量。
(1)若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则Q???? 184.8kJ(填“>”、“<”或“=”)。 一定条件下,在密闭恒容的容器中,能表示反应达到化学平衡状态的是??????????? 。
a.3v逆(N2)=v正(H2)? ???????? b.2v正(H2)= v正(NH3)
c.混合气体密度保持不变 ???? d.c(N2):c(H2):c(NH3)=1:3:2
工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为
2NH3 (g)+ CO2 (g) CO(NH2)2 (l)+ H2O (l)。
CO(NH2)2 (l)+ H2O (l)。
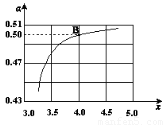
(2)在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比) ,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是?????????? 。
,右图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是?????????? 。
(3)图中的B点处,NH3的平衡转化率为?????? 。
(4)已知:? 3Cl2+2NH3→N2+6HCl????? ――①?? 3Cl2+8NH3→N2+6NH4Cl??? ――②
完成并配平下列氧化还原反应方程式:12Cl2+15NH3→?????????????????????? ――③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com