
| A. | 还原性Cl-、Br-、I- | B. | 碱性:Na0H、Mg(OH)2、Al(OH)3 | ||
| C. | 稳定性HCl、H2S、PH3 | D. | 酸性:HC1O4、H2SO4、H2CO3 |
分析 A.元素的非金属性越强,其阴离子的还原性越弱;
B.元素的金属性越强,其最高价氧化物的水化物的碱性越强;
C.元素的非金属性越强,其氢化物的稳定性越强;
D.元素的非金属性越强,其最高价氧化物的水化物的酸性越强.
解答 解:A.元素的非金属性越强,其阴离子的还原性越弱,非金属性:Cl、Br、I依次减弱,则Cl-、Br-、I-的还原性依次增强;
B.元素的金属性越强,其最高价氧化物的水化物的碱性越强,金属性:Na、Mg、Al依次减弱,则Na0H、Mg(OH)2、Al(OH)3的碱性依次减弱;
C.元素的非金属性越强,其氢化物的稳定性越强,非金属性:Cl、S、P依次减弱,则HCl、H2S、PH3的稳定性依次减弱;
D.元素的非金属性越强,其最高价氧化物的水化物的酸性越强,非金属性:Cl、S、C依次减弱,则HC1O4、H2SO4、H2CO3的酸性依次减弱;
综上可知A选项中离子还原性依次增强,B、C、D三个选项中物质性质的递变都是依次减弱;
故选A.
点评 本题考查了元素周期律,注意把握元素性质的递变规律,题目难度不大,侧重于考查金属性和非金属性强弱比较.


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:选择题
| A. | 2CH3CH2OH $→_{140℃}^{浓H_{2}SO_{4}}$ CH3CH2OCH2CH3+H2O | |
| B. | CH3COOC2H5+H2O $→_{△}^{稀H_{2}SO_{4}}$ CH3COOH+C2H5OH | |
| C. |  +3Br2→ +3Br2→ +3HBr +3HBr | |
| D. |  +CH2=CH2$→_{△}^{催化剂}$ +CH2=CH2$→_{△}^{催化剂}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | |
| B. | 用电子天平称量化学药品时,必须先称小烧杯的质量,再称量加入试剂后的总质量,两者之差即为药品的质量 | |
| C. | 金属着火时,可用细沙覆盖灭火;电器设备引起的火灾,可用泡沫灭火器灭火 | |
| D. | 在酚酞溶液中加入过氧化钠粉末,溶液颜色会先变红后褪色,并且有气泡生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、U、W是原子序数依次增大的前四周期元素.其中Y的原子核外有7种运动状态不同的电子;X、Z中未成对电子数均为2;U是第三周期元素形成的简单离子中半径最小的元素;W的内层电子全充满,最外层只有1个电子.请回答下列问题:
X、Y、Z、U、W是原子序数依次增大的前四周期元素.其中Y的原子核外有7种运动状态不同的电子;X、Z中未成对电子数均为2;U是第三周期元素形成的简单离子中半径最小的元素;W的内层电子全充满,最外层只有1个电子.请回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②③④⑤⑥ | C. | ①③④⑤ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  稀释浓硫酸 | B. |  比较MnO2、CI2、I2的氧化性 | ||
| C. |  分离乙醇和水 | D. |  比较Na2CO3、NaHCO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发展氢能和太阳能 | B. | 限制塑料制品的使用 | ||
| C. | 提高原子利用率,发展绿色化学 | D. | 尽量用纯液态有机物代替水作溶剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
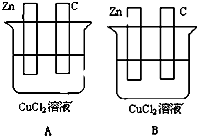 如图所示,A、B两烧杯中均为CuCl2溶液,在两极加以必要的连接并填空:
如图所示,A、B两烧杯中均为CuCl2溶液,在两极加以必要的连接并填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -16xQ | B. | -5xQ | C. | -4xQ | D. | -2xQ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com