
| A. | 22.4LO2所含的分子数目为NA | |
| B. | 0.5molH2O含有的原子数目为1.5NA | |
| C. | 7.8gmolNa2O2与H2O反应转移电子数目为0.1NA | |
| D. | 0.5NA个氯气分子的物质的量是0.5mol |
分析 A、氧气所处的状态不明确;
B、水中含3个原子;
C、求出过氧化钠的物质的量,然后根据1mol过氧化钠反应时转移1mol电子来分析;
D、物质的量n=$\frac{N}{{N}_{A}}$.
解答 解:A、氧气所处的状态不明确,故无法根据气体求出其物质的量和分子个数,故A错误;
B、水中含3个原子,故0.5mol水中含1.5mol原子即1.5NA个,故B正确;
C、7.8g过氧化钠的物质的量为0.1mol,而1mol过氧化钠反应时转移1mol电子,故0.1mol过氧化钠转移0.1mol电子即0.1NA个,故C正确;
D、氯气的物质的量n=$\frac{N}{{N}_{A}}$=$\frac{0.5{N}_{A}}{{N}_{A}}$=0.5mol,故D正确.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
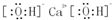 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
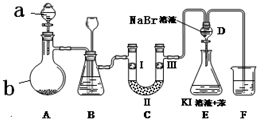 实验室用如图所示装置制备氯气并进行一系列相关的实验(夹持设备已省略).
实验室用如图所示装置制备氯气并进行一系列相关的实验(夹持设备已省略).| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 无水氯化钙 | 浓硫酸 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蒸发皿加热蒸发溶液时,盛液体的量不能超过其容积的$\frac{1}{3}$ | |
| B. | 用托盘天平可称10.50g K2SO4晶体 | |
| C. | 用10mL量筒量取8.50mL稀H2SO4溶液 | |
| D. | 加热坩埚不需要垫石棉网 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定不含I- | B. | 肯定不含Cu2+ | C. | 可能含有SO32- | D. | 肯定不含有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | (1) | (2) | (3) | (4) |
| 反应速率[mol/(L.s)] | v(SO2) | v(O2) | v(SO3) | v(O2) |
| 0.4 | 0.25 | 0.5 | 0.3 |
| A. | (1) | B. | (2) | C. | (3) | D. | (4) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨能在空气中燃烧,生成N2和水 | |
| B. | NO2溶于水生成HNO3,NO2属于酸性氧化物 | |
| C. | 所有的铵盐加热分解都能产生NH3 | |
| D. | 铜与浓硝酸反应时,硝酸既表现氧化性又表现酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯. | D装置中:溶液变红 E装置中:水层溶液变黄,振荡后,CCl4层无明显变化. | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为:Cl2>Br2>Fe3+ |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com