
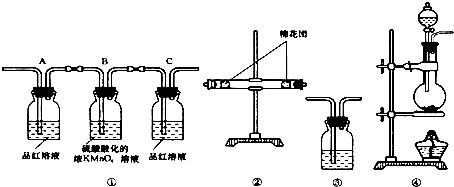
分析 (1)加热条件下,木炭和浓硫酸发生氧化还原反应生成二氧化碳、二氧化硫和水;
(2)二氧化碳和二氧化硫都能使澄清石灰水变浑浊,但二氧化硫能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,能使品红溶液褪色而具有漂白性,但二氧化碳没有此性质,所以检验二氧化碳之前先检验二氧化硫,水蒸气用无水硫酸铜检验,仪器连接顺序是:气体制备→水蒸气检验→二氧化硫检验→除去二氧化硫→二氧化硫检验→二氧化碳检验;
(3)A的作用是检验二氧化硫、B的作用是除去二氧化硫、C的作用是检验二氧化硫是否存在;
(4)水蒸气能使无水硫酸铜由无色变为蓝色,可以用无水硫酸铜检验水蒸气;
(5)实验室用澄清石灰水检验二氧化碳.
解答 解:(1)加热条件下,木炭和浓硫酸发生氧化还原反应生成二氧化碳、二氧化硫和水,反应方程式为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(2)二氧化碳和二氧化硫都能使澄清石灰水变浑浊,但二氧化硫能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,能使品红溶液褪色而具有漂白性,但二氧化碳没有此性质,所以检验二氧化碳之前先检验二氧化硫,水蒸气用无水硫酸铜检验,仪器连接顺序是:气体制备→水蒸气检验→二氧化硫检验→除去二氧化硫→二氧化硫检验→二氧化碳检验,所以其连接顺序是④→②→①→③,
故答案为:④;②;①;③;
(3)实验时可观察到装置①中A瓶的溶液褪色c瓶的溶液不褪色,说明通过c瓶后气体中不含二氧化硫,
A的作用是检验二氧化硫,利用品红溶液褪色检验二氧化硫;
二氧化硫具有还原性、酸性高锰酸钾具有强氧化性,二者发生氧化还原反应而使酸性高锰酸钾溶液褪色,所以B的作用是除去二氧化硫;
C的作用是检验二氧化硫是否存在,防止干扰二氧化碳检验,
故答案为:检验二氧化硫;除去二氧化硫;检验二氧化硫是否除尽;
(4)水蒸气能使无水硫酸铜由无色变为蓝色,可以用无水硫酸铜检验水蒸气,所以装置②中所装的固体药品是无水硫酸铜,也验证的产物是水,
故答案为:无水硫酸铜;H2O;
(5)二氧化碳能使澄清石灰水变浑浊,所以实验室用澄清石灰水检验二氧化碳,则装置③中所盛溶液是澄清石灰水,故答案为:澄清石灰水;二氧化碳.
点评 本题以浓硫酸为载体考查性质实验方案设计,明确实验原理是解本题关键,知道物质检验先后顺序及检验试剂的选取方法,难点是实验装置排列顺序,题目难度不大.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:选择题
| A. | 加入硝酸酸化的硝酸钡溶液 | B. | 先加硝酸酸化,再加入硝酸钡溶液 | ||
| C. | 加盐酸酸化了的BaCl2溶液 | D. | 先加盐酸酸化,再加入BaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
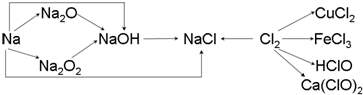
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
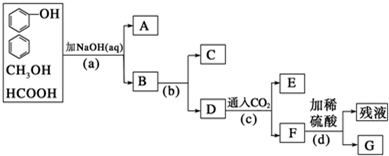
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称取8g NaOH固体放入烧杯中,加入100 mL蒸馏水,并不断搅拌至固体溶解 | |
| B. | 称取8g NaOH固体,放入100 mL容量瓶中,加入蒸馏水使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀 | |
| C. | 称取8 g NaOH固体,放入100 mL量筒中,加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100 mL | |
| D. | 称取8g NaOH固体放入烧杯中,加入适量蒸馏水溶解,冷却后将烧杯中溶液注入100 mL容量瓶后,用少量蒸馏水洗涤烧杯内壁2~3次 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y和Z互为同位素 | |
| B. | X和Y能化合成两种化合物 | |
| C. | X和Y化合的产物中一定不含有共价键 | |
| D. | X离子比R的离子半径大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com