
| 100mL |
| 20mL |
| 0.440g |
| 0.700 |
| 1 |
| 2 |
| 1 |
| 2 |
| 100mL |
| 20mL |
| 0.1749g |
| 0.700g |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 某同学设计了如下方案,来测定过氧化钠的样品的纯度(杂质不参加反应,条件为标准状况).
某同学设计了如下方案,来测定过氧化钠的样品的纯度(杂质不参加反应,条件为标准状况).查看答案和解析>>
科目:高中化学 来源: 题型:

 )
)查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 环境温度/°C | 5 | 10 | 15 | 20 | 25 | 30 | 35 |
| 显色时间/min | 45 | 30 | 15 | 13 | 10 | 7 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室里有一瓶试剂的标签部分被腐蚀,如图所示,仅知该试剂是只含短周期元素的纯净物.某同学设计实验探究该试剂成分,实验现象和结论都正确的是( )
实验室里有一瓶试剂的标签部分被腐蚀,如图所示,仅知该试剂是只含短周期元素的纯净物.某同学设计实验探究该试剂成分,实验现象和结论都正确的是( )| A、取该样品加入足量的硝酸钡溶液和稀盐酸,产生白色沉淀,则该样品的成分一定是硫酸钠 |
| B、取该样品溶于水,测得溶液pH=10,将溶液放置在空气中,一段时间后再测定溶液pH=7,该样品可能是亚硫酸钠 |
| C、取该样品溶于水,加入足量稀硫酸,将产生气体通入品红溶液,品红溶液褪色,加热溶液变红色,则样品成分是Na2S |
| D、若样品成分是硅酸钠(Na2SiO3),溶于水,滴加盐酸至过量,先生成白色沉淀,后沉淀溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
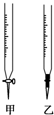 温州某学生用0.1000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
温州某学生用0.1000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:| 滴定次数 | 待测液体积/mL | 标准溶液的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | |||
| 1 | 20 | 1.02 | 21.03 | |
| 2 | 20 | 2.00 | 25.00 | |
| 3 | 20 | 0.60 | 20.59 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
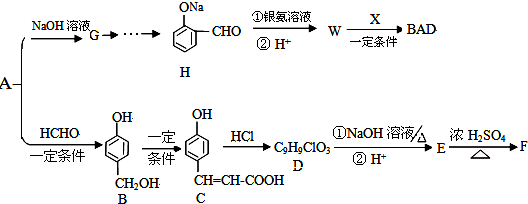
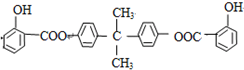
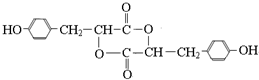
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com