
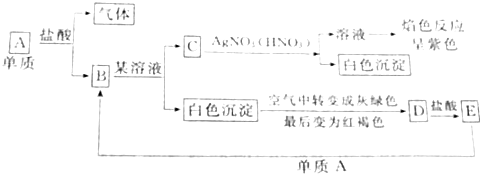
 根据图示填空:
根据图示填空:分析 C与硝酸银反应后的溶液焰色反应呈紫色,则含有C含有K元素,白色沉淀应为AgCl,由生成D的现象可知D为Fe(OH)3,则白色沉淀为Fe(OH)2,E为FeCl3,可知B为FeCl2,C为KCl,A应为Fe,生成气体为氢气,FeCl2与KOH反应Fe(OH)2,以此解答该题.
解答 解:C与硝酸银反应后的溶液焰色反应呈紫色,则含有C含有K元素,白色沉淀应为AgCl,由生成D的现象可知D为Fe(OH)3,则白色沉淀为Fe(OH)2,E为FeCl3,可知B为FeCl2,C为KCl,A应为Fe,生成气体为氢气,FeCl2与KOH反应Fe(OH)2,
(1)由以上分析可知A为Fe,B为FeCl2,C为KCl,D为Fe(OH)3,E为,故答案为:Fe;FeCl2;KCl;Fe(OH)3;FeCl3;
(2)生成D的反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)E为FeCl3,可与Fe反应生成FeCl2,反应的离子方程式为2Fe3++Fe=3Fe2+,故答案为:2Fe3++Fe=3Fe2+.
点评 本题考查无机物的推断,为高频考点和常见题型,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,注意把握物质的转化关系,难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同温度下,1mol/L氨水溶液与0.5mol/L氨水溶液中C(OH-)之比是2:1 | |
| B. | 0.1mol/LNH4Cl溶液中C(Cl-)=C(NH4+) | |
| C. | 向0.1mol/LNaNO3溶液中滴加稀盐酸,使溶液PH=5,此时混合液中C(Na+)=C(NO3-) | |
| D. | 向CH3COONa溶液中加入适量CH3COOH,使混合液的PH>7,此时混合液中C(CH3COOH)>C(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、Cl-、Na+、SO42- | B. | Al3+、K+、HCO3-、Cl- | ||
| C. | H+、Fe3+、NO3-、SO42- | D. | H+、Na+、Cl-、CO32-、 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
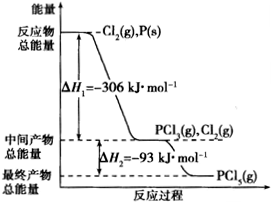 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中△H的表示生成1mol产物的数据).
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中△H的表示生成1mol产物的数据).查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为N2O.
;一种由B、C组成的化合物与AC2互为等电子体,其化学式为N2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO能使人中毒的原理是CO能将人体血液中的Fe2+氧化 | |
| B. | 雷雨过后感觉到空气清新是因为空气中产生了少量的二氧化氮 | |
| C. | 推广使用煤液化技术,可减少二氧化碳等温室气体的排放 | |
| D. | 利用铜、锶、钡等金属化合物的焰色反应制造节日烟花 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com