
有X、Y两种元素,原子序数≤20,X的原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数).下列说法正确的是( )
|
| A. | 若X元素形成的单质是X2,则Y元素形成的单质一定是Y2 |
|
| B. | 若Y的最高正价为+m,则X的最高正价一定为+m |
|
| C. | 若X(OH)n为强碱,则Y(OH)n也一定为强碱 |
|
| D. | 若HnXOm为强酸,则X的氢化物溶于水一定显酸性 |
考点:
原子结构与元素的性质.
专题:
元素周期律与元素周期表专题.
分析:
X、Y原子的最外层电子数相同,说明位于同一主族,X的原子半径小于Y,则原子序数Y大于X,根据同主族元素性质的递变规律判断.
解答:
解:X、Y原子的最外层电子数相同,说明位于同一主族,X的原子半径小于Y,则原子序数Y大于X,则:
A.若X形成的单质是N2,则Y元素形成的单质可以是红磷或者白磷,白磷的分子式为P4,故A错误;
B.若Y的最高正价为+m,X不一定有正价,如Cl的最高正价为+7价,而F的最高价为0价,故B错误;
C.如X、Y为金属元素,同主族元素从上到下元素的金属性逐渐增强,对应的最高价氧化物的水化物的碱性逐渐增强,若X(OH)n为强碱,则Y(OH)n也一定为强碱,故C正确;
D.若HnXOm为硝酸,则X的氢化物为氨气,为碱性气体,溶于水呈碱性,故D错误;
故选C.
点评:
本题考查原子结构与元素的性质,题目难度不大,本题注意同主族元素性质的递变规律.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
某研究小组决定用实验探究的方法证明化学反应具有一定的限度,在一定条件下会达到“平衡状态”。取5 mL 0.1 mol·L-1 KI溶液于试管中,滴加0.1 mol·L-1 FeCl3溶液2 mL,发生如下反应:2Fe3++2I-===2Fe2++I2。为证明该反应具有可逆性且达到一定限度,他们设计了如下实验:
①取少量反应液,滴加AgNO3溶液,发现有少量黄色沉淀(AgI),证明反应物没有反应完全;
②再取少量反应液,加入少量CCl4,振荡,发现CCl4层显浅紫色,证明萃取到I2,即有I2生成。
结合①②的结论,他们得出该反应具有一定的可逆性,在一定条件下会达到反应限度。
(1)老师指出他们上述实验①不合理,你认为是____________;
改进的方法是________________________________________。
(2)有人认为步骤②适合检验生成I2较多的情况下,还有一种简便方法可以灵敏地检验是否生成了I2,这种方法是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
|
| A. | H2O的电子式: |
|
| B. | 质量数为14的碳原子: |
|
| C. | CO2的比例模型: |
|
| D. | Cl﹣的结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质,化学键类型相同、晶体类型相同且熔化时破坏作用力类型也相同的是( )
|
| A. | 金刚石 石墨 | B. | H2S CCl4 | C. | NH4Cl KCl | D. | CO2 SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一体积不变的密闭容器中发生如下化学反应:2A(g)⇌B(g)+2C(g).当物质A的起始浓度为1.0mol•L﹣1、物质B、C的起始浓度为0时,物质A的浓度、转化率以及物质B的浓度随反应时间的变化如各图所示:
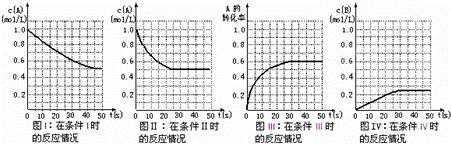
下列有关说法中正确的是( )
|
| A. | 条件Ⅰ、条件Ⅱ时的反应温度不同,压强相同 |
|
| B. | 条件Ⅰ时可能未使用催化剂,条件Ⅱ时可能使用了催化剂 |
|
| C. | 条件Ⅲ时的平衡混合物中,物质C的浓度等于0.6mol•L﹣1 |
|
| D. | 条件Ⅳ和条件Ⅱ相比较,条件Ⅳ时可能增大了反应体系的压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素.实验条件作如下限定:所用KMnO4酸性溶液的浓度可选择0.01mol·L﹣1、0.001mol·L﹣1,催化剂的用量可选择0.5g、0g,实验温度可选择298K、323K.每次实验KMnO4酸性溶液的用量均为4mL、H2C2O4溶液(0.1mol·L﹣1)的用量均为2mL.
(1)配平化学方程式:
KMnO4+ H2C2O4+ H2SO4→ K2SO4+ MnSO4+ CO2+ H2O
(2)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
| 实验编号 | T/K | 催化剂的用量/g | KMnO4酸性溶液的浓度/mol·L﹣1 | 实验目的 |
| ① | 298 | 0.5 | 0.01 | (Ⅰ)实验①和②探究KMnO4酸性溶液的浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和 ④ 探究催化剂对该反应速率的影响 |
| ② | ||||
| ③ | ||||
| ④ | 0 |
(3)在完成探究催化剂对该反应速率影响的实验时发现,未加催化剂的情况下,刚开始一段时间,反应速率较慢,溶液褪色不明显,但不久后突然褪色,反应速率明显加快.
针对上述实验现象,同学认为高锰酸钾与草酸溶液的反应放热,导致溶液温度升高,反应速率加快,从影响化学反应速率的因素看,你猜想还可能是
若用实验证明你的猜想.除酸性高锰酸钾溶液,草酸溶液外,还需要选择的试剂最合理的是
A.硫酸钾 B.硫酸锰 C.二氧化锰 D.水
(4)某同学对实验①和②分别进行三次实验,测得以下实验数据(从混合振荡均匀开始计时):
| KMnO4酸性溶液 的浓度/mol·L﹣1 | 溶液褪色所需时间 t/min | ||
| 第1次 | 第2次 | 第3次 | |
| 0.01 | 14 | 13 | 11 |
| 0.001 | 6 | 7 | 7 |
计算用0.001 mol·L﹣1 KMnO4酸性溶液进行实验时KMnO4的平均反应速率 (忽略混合前后溶液体积的变化).
(5)若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行? .若不可行(若认为可行则不填),请设计可以通过直接观察褪色时间长短来判断的改进方案 .
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应X+3Y2⇌Z+Q,在某段时间内以X的浓度变化表示的化学反应速度为1mol.L﹣1.min﹣1,则此段时间内以Z的浓度变化表示的化学反应速率为( )
|
| A. | 0.5mol•L﹣1•min﹣1 | B. | 1mol•L﹣1•min﹣1 |
|
| C. | 3mol•L﹣1•min﹣1 | D. | 2mol•L﹣1•min﹣1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com