
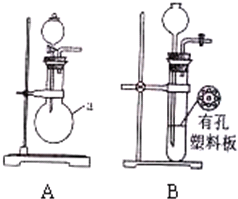
 (1)用A装置制SO2,化学反应方程式为Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑.
(1)用A装置制SO2,化学反应方程式为Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑.分析 (1)制备二氧化硫是利用亚硫酸钠和浓硫酸反应生成;
(2)装置B是利用了启普发生器的原理,可以随时进行随时停止.
解答 解:(1)制备二氧化硫是利用亚硫酸钠和浓硫酸反应生成,反应的化学方程式为:Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑,
故答案为:Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑;
(2)装置B是利用了启普发生器的原理,固体碳酸钙放在塑料板上,从长颈漏斗中加入稀盐酸,浸没碳酸钙反应生成二氧化碳气体,不需要时关闭活塞,随气体生成试管中压强增大,溶液被压入长颈漏斗,液体可以随时进行随时停止,
故答案为:随时控制反应的发生和停止.
点评 本题考查了二氧化硫、二氧化碳制备原理、制备装置和试剂选择等知识,掌握基础是解题关键,题目较简单.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;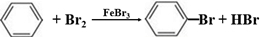 ,A的二溴代物的同分异构体有3种;
,A的二溴代物的同分异构体有3种;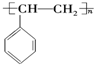 ,其单体是
,其单体是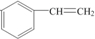 (填结构简式),写出一定条件下该单体与足量氢气反应的化学方程式
(填结构简式),写出一定条件下该单体与足量氢气反应的化学方程式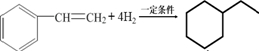 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
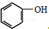 (制酚醛树脂)④
(制酚醛树脂)④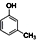 (生产杀虫剂)⑤CH2=CH─CH=CH2(合成橡胶原料)⑥HCHO(防腐剂)
(生产杀虫剂)⑤CH2=CH─CH=CH2(合成橡胶原料)⑥HCHO(防腐剂)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
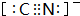 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com