
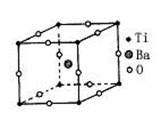
| A.BaTi8O12 | B.BaTi4O6 |
| C.BaTi2O4 | D.BaTiO3 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.金属晶体和离子晶体(固态时)都能导电 |
| B.在镁晶体中,1个Mg2+只与2个价电子存在强烈的相互作用 |
| C.金属晶体和离子晶体都可采取“紧密堆积”方式 |
| D.金属晶体和离子晶体中分别存在金属键和离子键等强烈的相互作用,很难断裂,因而都具有延展性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.构成离子晶体的作用力可能是离子键也可能是共价键 |
| B.氯化铯晶体是由氯化铯分子构成的 |
| C.由于离子的带电量有限,一个离子可以同时吸引的带相反电荷的离子数也有限 |
| D.一种离子化合物如果适合作耐高温材料,它的晶格能一定相当大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.金属原子半径都较大,价电子较少 |
| B.金属受外力作用后,金属离子与自由电子仍保持其较强的作用 |
| C.金属中的大量自由电子,受外力作用后,运动速度加快 |
| D.自由电子能迅速传递能量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.熔化状态下能导电的物质一定是离子化合物 |
| B.P4和NO2都是共价化合物 |
| C.在氧化钙和二氧化硅晶体中都不存在单个的小分子 |
| D.离子化合物中一定不存在单个的分子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.热稳定性:PH3>H2S>HBr>NH3 |
| B.物质的熔点:石英>食盐>冰>汞 |
| C.结合质子的能力:CO32->CH3COO->SO42- |
| D.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCI3溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe2+0.45Fe3+0.50O | B.Fe2+0.85Fe 3+0.10O |
| C.Fe2+0.15Fe3+0.80O | D.Fe2+0.20Fe 3+0.75O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com