
| A. | 氧化反应 | B. | 分解反应 | C. | 水解反应 | D. | 缩合反应 |
分析 食物中含有六大类营养物质:蛋白质、糖类、脂肪、维生素、水和无机盐,葡萄糖作为营养剂糖类中的单糖,能供给人体能量,所以它在体内发生的主要反应是氧化反应,据此即可解答.
解答 解:葡萄糖在人体组织中缓慢氧化放出热量,供给人体所需能量,这是人类生命活动所需能量的重要来源之一.葡萄糖的结构简式为CH2OH(CHOH)4CHO,在体内经缓慢氧化生成二氧化碳和水,释放出能量,每克葡萄糖放出热量为15.6kJ,在人体中反应的方程式为C6Hl2O6+6O2$\frac{\underline{\;酶\;}}{\;}$ 6CO2+6H2O,所以A正确;
故选:A.
点评 本题考查了葡萄糖的性质,根据有关反应方程式就可解答,题目较简单.


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:选择题
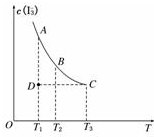 实验室将I2溶于KI溶液中,配制浓度较大的碘水,主要是因为发生了反应:I2(aq)+I-(aq)?I3-(aq),上述平衡体系中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态),下列说法不正确的是( )
实验室将I2溶于KI溶液中,配制浓度较大的碘水,主要是因为发生了反应:I2(aq)+I-(aq)?I3-(aq),上述平衡体系中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上的任何一点都表示平衡状态),下列说法不正确的是( )| A. | 该反应的正反应是吸热反应 | B. | A点与C点的化学反应速率vA<vC | ||
| C. | 在反应进行到D点时,v正>v逆 | D. | A点与B点相比,B点的c(I2)大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2+Na2SO4═BaSO4↓+2NaOH | B. | BaCl2+Na2SO4═BaSO4↓+2NaCl | ||
| C. | BaCO3+H2SO4═BaSO4↓+CO2↑+H2O | D. | BaCl2+H2SO4═BaSO4↓+2HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 弱碱性溶液中:Na+、K+、Cl-、HCO3- | |
| B. | “84”消毒液中:SiO32-、CO32-、Na+、S2- | |
| C. | 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl- | |
| D. | 0.1 mol•L-1FeCl3溶液中:Fe2+、NH4+、SCN-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2、HC1、H2O | B. | HC1、H2O、O2 | C. | HC1、H2O | D. | CO2、O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com