B
分析:A、根据FeCl
3溶液中铁离子的水解来分析;
B、根据过氧化钠的电子式来分析;
C、常温常压下,无法计算22.4LCH
4气体的物质的量;
D、根据稀盐酸不与MnO
2反应来分析.
解答:A、100mL1mol/LFeCl
3溶液中溶质的物质的量为0.1L×1mol/L=0.1mol,但铁离子水解,则液中含阳离子数小于0.1NA,故A错误;
B、78gNa
2O
2的物质的量为
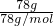
=1mol,1molNa
2O
2中含有2molNa
+和1molO
22-,则78gNa
2O
2中所含阴阳离子总数为3NA,故B正确;
C、常温常压下,无法计算22.4LCH
4气体的物质的量,则无法确定与足量Cl
2反应可生成CH
3Cl分子的物质的量,故C错误;
D、若1molHCl与足量MnO
2完全反应,转移电子数为0.5NA,但浓盐酸与足量MnO
2反应时随反应的进行,浓盐酸变为稀盐酸,而稀盐酸与MnO
2不反应,则转移电子数小于0.5NA,故D错误;
故选B.
点评:本题考查有关物质的量及阿伏伽德罗常数的计算,明确电子数等于质子数、氧化还原反应中电子的转移数目及质量、体积、微观粒子数、物质的量的关系是解答的关键,并注意利用标况下气体的摩尔体积来计算其物质的量.

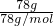 =1mol,1molNa2O2中含有2molNa+和1molO22-,则78gNa2O2中所含阴阳离子总数为3NA,故B正确;
=1mol,1molNa2O2中含有2molNa+和1molO22-,则78gNa2O2中所含阴阳离子总数为3NA,故B正确;
