
| A. | NaOH溶液 | B. | 溴水 | C. | 清水 | D. | 酸性KMnO4溶液 |
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | O4的摩尔质量是64g | |
| B. | O4与O3、O2互为同位素 | |
| C. | 相同质量的O4与O3所含原子个数之比为1:1 | |
| D. | 32gO4所含的电子数为32NA(NA为阿伏加德罗常数) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
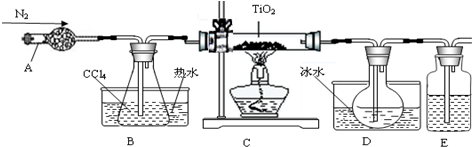
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ⑤ | C. | ②③⑤ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,18g14CH4所含中子数目为12NA | |
| B. | 7.8 g Na2S和Na2O2的混合物中含有的阴离子数大于0.1 NA | |
| C. | 常温常压下,1mol NaHCO3与足量稀硫酸反应,生成气体的体积大于22.4L | |
| D. | 1mol NaBH4与足量水反应(NaBH4+H2O→NaBO2+H2↑,未配平)时转移的电子数为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | ||
| Z |
| A. | 原子半径:r(Y)>r (Z)>r (W) | |
| B. | Y、Z、W的简单离子的电子层结构相同 | |
| C. | XWm与YWn中化学键类型相同(m、n为正整数) | |
| D. | 元素Z 的简单气态氢化物的热稳定性比W 的强 |
查看答案和解析>>
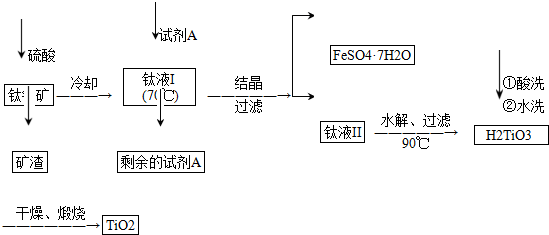
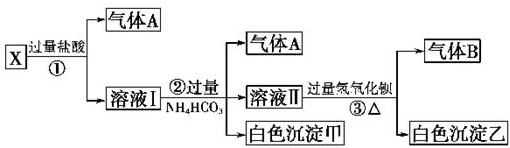
科目:高中化学 来源: 题型:推断题
 ,已知断裂1mol B-B键吸收167kJ的热量,生成1mol B≡B键放出942kJ热量.试判断相同条件下B4与B2的稳定性顺序是:N4<N2.
,已知断裂1mol B-B键吸收167kJ的热量,生成1mol B≡B键放出942kJ热量.试判断相同条件下B4与B2的稳定性顺序是:N4<N2.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
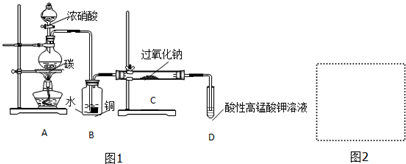

| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com