


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若生成1molFe,则放出a kJ热量 |
| B、若升高温度,则正反应速率加快,逆反应速率减慢,化学平衡正向移动 |
| C、若容器内压强不随时间变化,则可以判断该反应已达到化学平衡状态 |
| D、达到化学平衡状态时,若c(CO)=0.100 kJ/mol,则c(CO2)=0.0263 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
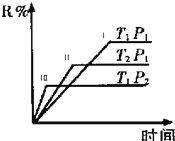 在密闭容器中进行下列反应:(g)+N(g)?R(g)+2L,在不同条件下R的百分含量R%的变化情况如下图,下列叙述正确的是( )
在密闭容器中进行下列反应:(g)+N(g)?R(g)+2L,在不同条件下R的百分含量R%的变化情况如下图,下列叙述正确的是( )| A、正反应吸热,L是气体 |
| B、正反应吸热,L是固体 |
| C、正反应放热,L是气体 |
| D、正反应放热,L是固体或液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑤ | B、①②⑤ |
| C、②③④ | D、①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
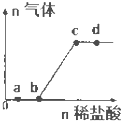 向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如右图所示.则下列离子组在对应的溶液中一定能大量共存的是( )
向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如右图所示.则下列离子组在对应的溶液中一定能大量共存的是( )| A、a点对应的溶液中:Na+、OH-、SO42-、NO3- |
| B、b点对应的溶液中:Al3+、Fe3+、NO3-、Cl- |
| C、c点对应的溶液中:Na+、Ca2+、NO3-、Cl- |
| D、d点对应的溶液中:Cl-、NO3-、Fe2+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A、B、AB的物质的量浓度之比一定为1:1:2 |
| B、A、B全部转化为AB |
| C、容器内各物质的浓度不随时间变化 |
| D、单位时间内减少x mol A2,同时生成2x mol AB |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、m=n | B、m>n |
| C、m<n | D、无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化产物与还原产物的物质的量之比为1:2 |
| B、I2的还原性强于Cl2 |
| C、标准状况下产生11.2 L Cl2,转移电子为1 mol |
| D、Cl2和I2都是氧化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com