
| A. | 有机化合物都是共价化合物 | |
| B. | 有机化合物都含有碳、氢元素 | |
| C. | 有机化合物都具有同分异构现象 | |
| D. | 有机物种类多是由碳原子的成键特征决定的 |
分析 A.高脂脂肪酸盐为离子化合物;
B.卤代烃中可能不含H;
C.甲烷、乙烷等不存在同分异构体;
D.碳能形成4个价键,可形成单键、双键、三键或成环状,且存在同分异构现象.
解答 解:A.高脂脂肪酸盐为离子化合物,大多数有机物为共价化合物,故A错误;
B.卤代烃中可能不含H,如四氯化碳不含H,故B错误;
C.甲烷、乙烷等不存在同分异构体,大多数有机物具有同分异构现象,故C错误;
D.碳能形成4个价键,可形成单键、双键、三键或成环状,且存在同分异构现象,则有机物种类多是由碳原子的成键特征决定的,故D正确;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意有机物的组成,题目难度不大.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 明矾可以作净水剂 | |
| B. | 配制硫酸铁溶液时,先把硫酸铁晶体溶解在稀硫酸中,再加水稀释至所需浓度 | |
| C. | 加热稀氨水其溶液pH稍有变化 | |
| D. | 热的纯碱溶液可以去油污 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
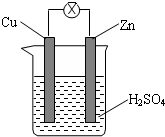
| A. | Zn是负极,发生还原反应 | |
| B. | 电子从锌片经外电路流向铜片 | |
| C. | 一段时间后溶液变蓝 | |
| D. | 铜片上可见气泡,一段时间后溶液总质量减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
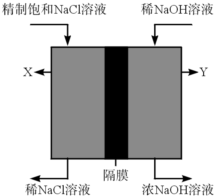 以海水为主要原料的海洋化学工业,被称为“蓝色化工”.氯碱工业是“蓝色化工”重要的组成部分,其化学反应原理是电解饱和食盐水.
以海水为主要原料的海洋化学工业,被称为“蓝色化工”.氯碱工业是“蓝色化工”重要的组成部分,其化学反应原理是电解饱和食盐水.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 铜丝与盐酸不反应,可以用铜丝代替铂丝做焰色反应 | |
| B. | 用铂丝蘸取某溶液在酒精灯的火焰上灼烧时,火焰呈黄色,说明原溶液中是钠盐 | |
| C. | 某溶液在灼烧时透过蓝色钴玻璃看到火焰呈紫色,说明原溶液中含有K+ | |
| D. | 所有的金属及其化合物都有焰色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 L CCl4中含Cl原子数目为0.4NA | |
| B. | 白磷分子(P4)呈正四面体结构,12.4 g白磷中含有P-P键数目为0.6NA | |
| C. | 1mol氯气参加氧化还原反应,转移的电子数一定为2NA | |
| D. | 5.6g Fe和足量的盐酸反应时,失去的电子数为0.3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com