
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,23g NO2中含有NA个O原子 | |
| B. | 16g CH4中含有NA个C-H共价键 | |
| C. | 标准状态下,2.24L水中所含的分子数为0.1NA | |
| D. | 在0.1mol/L AlCl3溶液中所含的Cl- 的个数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25g质量分数68%的H2O2水溶液中含氧原子数目为NA | |
| B. | 0.1mol•L-1 NH4Cl溶液中含有NH4+的数目小于0.1NA | |
| C. | 100mL 12mol•L-1 的浓HNO3与过量Cu反应转移电子的数目为0.6NA | |
| D. | 标准状况下,11.2L由C2H4和C3H4 组成的混合气体中含有氢原子的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
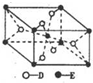
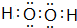 ,E的基态原子的外围电子排布式为3d24s2.
,E的基态原子的外围电子排布式为3d24s2.| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
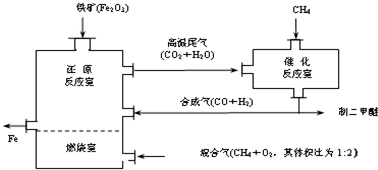
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与氢氧化钠溶液反应 | B. | 使溴的四氯化碳溶液褪色 | ||
| C. | 与金属钠反应放出氢气 | D. | 使高锰酸钾溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com