
下列说法正确的是
A.用精密pH试纸测得饱和氯水的pH约为2.2
B.配制一定物质的量浓度的溶液,定容时仰视刻度,溶液浓度偏小
C.在中和滴定实验中,锥形瓶需用待测液润洗
D.制备乙酸乙酯时,将乙醇和乙酸依次加入浓硫酸中
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2013-2014湖北省高一下学期期中联考化学试卷(解析版) 题型:填空题
(11分)A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大;A有多种核素,其中一种没有中子;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的3/4,A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不同的多种化合物。请回答下列问题:
(1) F在元素周期表中的位置是_______________;用电子式表示A与F两种元素组成的化合物的
形成过程______________________________________________。
已知下表中的数据是破坏1 mol物质中的化学键所吸收的能量(kJ),元素A的单质与元素F的单质在一定条件下反应生成2mol产物时释放的能量为____________kJ。
化学键 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
(2)用离子方程式表示E、F两种元素的非金属性强弱
还可以验证E、F两种元素非金属强弱的是(填写字母)
A.比较这两种元素的常见单质的沸点
B.比较这两种元素的单质与氢气化合的难易
C.比较这两种元素的最高价氧化物水化物的酸性
(3) A、C、E两两之间可形成甲、乙两种微粒,它们均为带一个单位负电荷的双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省高一下学期期中联考化学试卷(解析版) 题型:选择题
化学与能源开发、环境保护、资源利用等密切相关。下列说法正确的是
A.天然气、石油、流水、风力、氢气为一级能源
B.无论是风力发电还是火力发电,都是将化学能转化为电能
C.PM 2.5含有的铅、镉、铬、钒、砷等对人体有害的元素均是金属元素
D.发展低碳经济、循环经济,推广利用太阳能、风能的城市照明系统
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省武汉市高三四月调考理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.向AgCl悬浊液中加入少量NaCl固体后振荡,c(Cl-)增大,KsP (AgCl)增大
B.某溶液中由水电离出的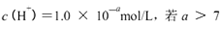 时,则该溶液的pH一定为14-a
时,则该溶液的pH一定为14-a
C. pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后溶液的pH等于7,则混合溶液
中: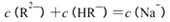
D.相同物质的量浓度的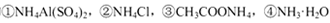 溶液中,c (NH4+)由大到小的顺序是:①>②>③>④
溶液中,c (NH4+)由大到小的顺序是:①>②>③>④
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省武汉外国语学校高一下学期期中考试化学试卷(解析版) 题型:填空题
(10分)
(1)铅蓄电池中,作负极材料的金属在元素周期表中的位置是________________,写出其正极的电极反应式______________________________________________________;
(2)汽车尾气分析仪对 CO 的分析 以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2- 可以在固体介质中自由移动。
下列说法错误的是___________________。

A.负极的电极反应式为:CO+O2-―2e =CO2
B.工作时电极 b 作正极,O2-由电极 a 流向电极 b
C.工作时电子由电极a通过传感器流向电极b
D.传感器中通过的电流越大,尾气中 CO 的含量越高
(3)某新型铝—空气燃料电池,以铝为负极,在正极通入空气,若以NaCl溶液或NaOH溶液为电解质溶液,放电时正极反应都为O2+2H2O+4e-=4OH-。那么若以NaOH溶液为电解质溶液,电池负极反应为______________;若以NaCl溶液为电解质溶液,则总反应为:____________。
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省武汉外国语学校高一下学期期中考试化学试卷(解析版) 题型:选择题
元素周期表中某区域的一些元素多用于制造半导体材料,它们是
A.左、下方区域的金属元素 B.金属元素和非金属元素分界线附近的元素
C.右、上方区域的非金属元素 D.稀有气体元素
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省宜昌市高三5月模拟理综化学试卷(解析版) 题型:选择题
在2 L的密闭容器中发生反应xA(g)+yB(g) zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是
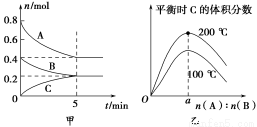
A.200 ℃时,反应从开始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
B.200℃时,该反应的平衡常数为25 L2/mol2
C.当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D.由图乙可知,反应xA(g)+yB(g) zC(g)的ΔH<0,且a=2
zC(g)的ΔH<0,且a=2
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省四校下学期期中考试高一化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数的值,下列叙述中不正确的是
A.Fe与标准状况下2.24LCl2恰好完全反应,转移电子数目为0.2NA
B.0.5molNa2O2和0.5molNa2O组成的混合物中,含阴离子数目为1.5NA
C.17gNH3分子中含有的共用电子对数为3NA
D.1.7gOH—所含电子总数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com