
| A. | NaOH溶液 | B. | 铁片 | C. | KSCN溶液 | D. | 石蕊溶液 |
分析 如果FeSO4溶液变质,变质后的物质是硫酸铁,溶液中一定存在铁离子,Fe3+能和SCN-生成络合物硫氰化铁,使溶液呈现血红色,据此进行检验即可.
解答 解:A、FeCl2和氢氧化钠溶液生成白色沉淀氢氧化亚铁,氢氧化亚铁不稳定,能迅速被氧化成灰绿色、最终氧化成红褐色,检验效果不如硫氰化钾溶液,故A错误;
B、铁片不与溶液中硫酸亚铁反应,无法检验硫酸亚铁是否变质,故B错误;
C、如果FeCl2溶液变质,变质后的物质是FeCl3,Fe3+能和SCN-生成络合物,使溶液呈现血红色现象明显,这一反应是Fe3+的特征反应,所以用KSCN溶液,故C正确;
D、铁离子和亚铁离子水解溶液显酸性,使用石蕊试液无法检验硫酸亚铁是否变质,故D错误;
故选C.
点评 本题考查了亚铁离子、铁离子的检验方法,题目难度不大,注意掌握常见的检验Fe3+的物质,如:KSCN(溶液变血红色)、苯酚(溶液呈紫色).


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径 A>B>D>C | B. | 原子序数 d>c>b>a | ||
| C. | 离子半径 C>D>B>A | D. | 单质的还原性 A>B>D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Fe3+、SO42- | B. | CO32-、Cl-、SO42- | C. | Ca2+、Br-、SO42- | D. | Na+、SO42-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4L氯气与足量的铜充分反应 | B. | 0.2mol浓硫酸与足量铜反应 | ||
| C. | 46g金属钠与足量的水反应 | D. | 56g铁与足量稀硝酸溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
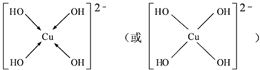 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | ① | |||||||
| 2 | ⑤ | ⑥ | ⑦ | |||||
| 3 | ② | ③ | ④ | ⑧ | ||||
| 4 | ⑨ | |||||||
| 5 | ⑩ |
 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com