
2005年1月美国科学家在《Science》上发表论文,宣布发现了铝的“超级原子”结构﹣Al13和Al14.已知这类“超级原子”最外层电子数之和为40个时处于相对稳定状态.下列说法中,正确的是( )
|
| A. | Al13、Al14互为同位素 |
|
| B. | Al13超原子中Al原子间通过离子键结合 |
|
| C. | Al14最外层电子数之和为42,与第ⅡA族元素的性质相似 |
|
| D. | Al13和Al14都具有较强的还原性,容易失去电子生成阳离子 |
| 核素;质量数与质子数、中子数之间的相互关系.. | |
| 专题: | 原子组成与结构专题. |
| 分析: | A.同位素的分析对象为质子数相同而中子数不同的原子,而超原子的质子、中子均相同; B.Al13 超原子中Al原子间是通过共有电子对成键; C.All4的价电子为3×14=42,当具有40个价电子时最稳定,当价电子数是42时,则易失去2个电子; D.Al13的价电子为3×13=39,易得电子,All4的价电子为3×14=42,易失去电子. |
| 解答: | 解:A.同位素的分析对象为质子数相同而中子数不同的原子,而超原子的质子、中子均相同,故A错误; B.Al13 超原子中Al原子间是通过共有电子对成键,所以以共价键结合,故B错误; C.All4的价电子为3×14=42,当具有40个价电子时最稳定,当价电子数是42时,则易失去2个电子,则与ⅡA族元素性质相似,故C正确; D.Al13的价电子为3×13=39,易得电子,形成阴离子,而All4的价电子为3×14=42,易失去电子,形成阳离子,故D错误; 故选C. |
| 点评: | 本题以信息的形式考查原子的结构与性质,注意信息中40个价电子时最稳定及铝的价电子是解答的关键,选项B为易错点,题目难度中等. |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成 离子化合物,由此可知
离子化合物,由此可知
| W | X | |
| Y | Z |
A.X、Y、Z中最简单氢化物稳定性最弱的是Y
B.Z元素氧化物对应水化物的酸性一定强于Y
C.X元素形成的单核阴离子还原性大于Y
D.Z元素单质在化学反应中只表现氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与化学反应能量变化相关的叙述正确的是 ( )。
A.生成物总能量一定低于反应物总能量
B.酒精可用作燃料,说明酒精燃烧是释放能量的反应
C.干冰气化需要吸收大量的热,这个变化是吸热反应
D.同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同
查看答案和解析>>
科目:高中化学 来源: 题型:
除去下列物质中所含少量杂质的所选试剂不正确的是( )
| 物 质 | 杂 质 | 试 剂 | |
| A | Cl2 | HCl | 饱和食盐水 |
| B | CO2 | HCl | 饱和Na2CO3溶液 |
| C | 金属镁 | 金属铝 | 稀NaOH溶液 |
| D | FeCl2 | FeCl3 | 铁粉 |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验的叙述正确的是( )
|
| A. | 除去水中的Na+、SO42﹣、Cl﹣等杂质可用蒸馏的方法 |
|
| B. | 除去Cu粉中混有的CuO:加适量稀硝酸后,过滤、洗涤 |
|
| C. | 用铂丝蘸取少量某溶液进行焰色反应,若火焰呈黄色,则原溶液含有钠盐 |
|
| D. | 某溶液加入盐酸酸化的BaCl2溶液,若有白色沉淀生成,则原溶液含有SO42﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定质量的NaHCO3分为三等份,第一份直接加入盐酸中,消耗盐酸物质的量为n1,第二份首先加热,使其部分分解后,再加入盐酸中,消耗盐酸物质的量为n2,第三份首先加热,使其完全分解后,再加入盐酸中,消耗盐酸物质的量为n3,假若与盐酸都完全反应,则n1、n2、n3的大小关系正确的是( )
|
| A. | n1=n2=n3 | B. | n2>n1>n3 | C. | n1>n2>n3 | D. | n1>n3>n2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式:
(2)H3PO2及NaH2PO2均可将溶液中的银离子还原为银单质,从而可用于化学镀银.
①H3PO2中,磷元素的化合价为
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为: (填化学式)
③NaH2PO2是正盐还是酸式盐?
(3)H3PO2的工业制法是:将白磷(P4)与氢氧化钡溶液反应生成PH3气体和Ba(H2PO2)2,后者再与硫酸反应,写出白磷与氢氧化钡溶液反应的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
非诺洛芬是一种治疗类风湿性关节炎的药物,可通过以下方法合成:
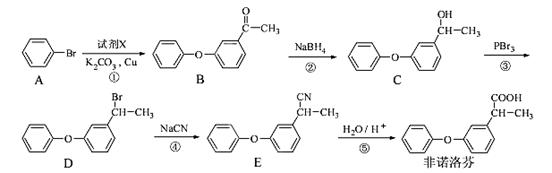
请回答下列问题:
(1)有机化合物B中的含氧官能团为 和 (填名称)。
(2)上述反应中,过程②属于 反应。
(3)若过程①发生的是取代反应,且另一种产物有HBr,写出由A到B发生反应的化学方程式 。
(4)非诺洛芬的一种同分异构体满足下列条件:
Ⅰ.能与NaHCO3反应放出CO2,能与FeCl3溶液发生显色反应;
Ⅱ.分子中有6种不同化学环境的氢,且分子中含有两个苯环。
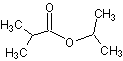
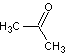 写出符合条件的一种同分异构体的结构简式: 。
写出符合条件的一种同分异构体的结构简式: 。
(5)根据已有知识并结合相关信息,写出以 为原料制备
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
CH3CH2OH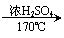
 CH2=CH2
CH2=CH2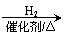
 CH3CH3
CH3CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
氮化硅是一种高温陶瓷材料,它的硬度大、熔点高,化学性质稳定,工业上曾普遍采用高纯硅与纯氮在1 300 ℃反应获得。
(1)根据性质,推测氮化硅陶瓷的用途是________(填字母)。
A.制汽轮机叶片 B.制有色玻璃
C.制永久性模具 D.制造柴油机
(2)画出N的原子结构示意图:________。根据元素周期律知识,请写出氮化硅的化学式:________________________________________________________________________。
(3)氮化硅陶瓷抗腐蚀能力强,除氢氟酸外,它不与其他无机酸反应,试推测该陶瓷被氢氟酸腐蚀的化学方程式:______________________________。
(4)现用四氯化硅和氮气在氢气气氛保护下,加强热发生反应,可得较高纯度的氮化硅,反应的化学方程式为______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com