
【题目】碱式碳酸镁不溶于水,用途广泛,主要用作橡胶制品的填充剂,能增强橡胶的耐磨性和强度。也可用作油漆和涂料的添加剂,也可用于牙膏、医药和化妆品等工业。以水氯镁石(主要成分为MgCl2·6H2O)为原料生产碱式碳酸镁的主要流程如下:
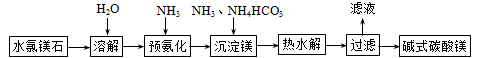
(1)预氨化过程中有Mg(OH)2沉淀生成,已知常温下Ksp(Mg(OH)2)=1.8×10-11,表示Mg(OH)2沉淀溶解平衡的方程式为 ,Mg(OH)2达到沉淀达到沉淀溶解平衡时溶液的pH (已知:lg36≈1.5)。
(2)已知:常温下Ka1(H2CO3)=4.4×10-7,Ka2(H2CO3)=4.7×10-11,Kb(NH3·H2O)=1.8×10-5,则NH4HCO3溶液显 性,c(NH) c(HCO)(选填“大于”、“小于”、“等于”),该溶液物料守恒表达式为 。
(3)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式为____________。
(4)高温煅烧碱式碳酸镁得到MgO。取碱式碳酸镁晶体4.84 g,高温煅烧至恒重,得到固体2.00 g和标准状况下CO2 0.896 L,则碱式碳酸镁的化学式为 ,写出氯化镁、氨、碳酸氢铵热水解生成碱式碳酸镁的离子方程式 。
【答案】(1)Mg(OH)2(s)![]() Mg2+(aq) + 2OH-(aq) 10.5
Mg2+(aq) + 2OH-(aq) 10.5
(2)酸 大于 c(NH4+)+ c(NH3·H2O)=c(CO32-)+ c(HCO3-) + c(H2CO3)
(3)NH4Cl (4)Mg(OH)2·4MgCO3·5H2O
5Mg2+ + 4HCO3-+ 6NH3 + 7H2O=Mg(OH)2·4MgCO3·5H2O↓+ 6NH4+
【解析】
试题分析:水氯镁石(主要成分为MgCl26H2O)为原料生产碱式碳酸镁的主要流程:加水溶解,通入氨气,氨气极易溶于水,得到碱性的氨水,再加入碳酸氢铵,再进行热水解可以将镁离子沉淀下来,形成碱式碳酸镁沉淀,过滤即可得到目标化合物。
(1)Mg(OH)2沉淀溶解生成镁离子和氢氧根离子,溶解的离子方程式为Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq),根据Ksp=c(Mg2+)c(OH-)2可知,c(OH-)=
Mg2+(aq)+2OH-(aq),根据Ksp=c(Mg2+)c(OH-)2可知,c(OH-)=![]() ,所以溶液的pH=10+
,所以溶液的pH=10+![]() =10.5。
=10.5。
(2)Ka1(H2CO3<Kb(NH3H2O),所以铵根离子的水解程度小于碳酸氢根离子,所以溶液中c(NH4+)>c(HCO3-),溶液呈碱性,根据氮元素和碳元素守恒可知物料守恒式为c(NH4+)+ c(NH3·H2O)=c(CO32-)+ c(HCO3-) + c(H2CO3);
(3)根据流程判断所得滤液的成分中含有的离子有氯离子和铵根离子,故所得的滤液中含NH4Cl;
(4)碳酸镁可以写成氧化物的表示形式,即xMgOyH2OzCO2,根据题意:碱式碳酸镁4.84g,高温煅烧至恒重,得到固体2.00g和标准状况下CO20.896L,即n(CO2)=0.896L÷22.4Lmol-1=4.00×10-2 mol,n(MgO)=2.00g÷40g/mol=5.00×10-2mol,
n(H2O)=![]() =5.00×10-2mol,
=5.00×10-2mol,
n(MgO):n(CO2):n(H2O)=5.00×10-2:4.00×10-2:5.00×10-2=5:4:5,
即x:y:z=5:4:5,所以碱式碳酸镁的化学式为:Mg(OH)2·4MgCO3·5H2O[或Mg5(OH)2(CO3)44H2O];用氯化镁、氨、碳酸氢铵热水解生成碱式碳酸镁的离子方程式为5Mg2+ + 4HCO3-+ 6NH3 + 7H2O=Mg(OH)2·4MgCO3·5H2O↓+ 6NH4+。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在处理废水时某反应体系中有6种粒子:N2、HCO3-、ClO-、CNO-、H2O、Cl-,在反应过程中部分离子浓度与反应进程关系如图所示。下列有关该反应的说法正确的是( )

A. 在上述反应体系中,CNO-是氧化剂
B. 还原产物与氧化产物的物质的量之比为1∶3
C. 在标准状况下,产生4.48 L N2时转移0.8 mol电子
D. 上述反应中,只有两种元素化合价发生了变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据实验操作和现象所得出的结论正确的是( )
选项 | 实验操作 | 实验现象 | 结论 |
A | 等体积 | 相同时间内 |
|
B | 将湿润的淀粉- | 试纸只在 | 氧化性: |
C | 将光亮的镁条放入盛有 | 有大量气泡产生 | 生成的气体是 |
D | 向NaHCO3溶液中加入NaAlO2溶液 | 有白色沉淀生成 |
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学——选修2:化学与技术)
甲酸钠广泛用作催化剂、稳定合成剂、印染行业的还原剂,还可用于生产保险粉、草酸和甲酸。甲酸钠用电石炉废气(75%~90% CO,以及少量CO2、H2S、N2、CH4等)合成,其合成部分工艺流程如图:
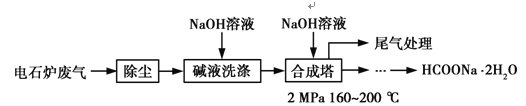
(1)上述工艺用碱液洗涤的目的是___________,可能发生的反应有______________(写两个化学方程式)。
(2)上述合成工艺中采用循环喷射吸收合成,其目的是_______________;最后尾气主要成分是__________________。
(3)甲酸钠高温时分解制取草酸钠(Na2C2O4)的化学方程式为__________________。
(4)在甲酸钠、氢氧化钠混合溶液中通入二氧化硫气体,可得到重要的工业产品保险粉(Na2S2O4),同时产生二氧化碳气体,该反应的离子方程式为___________________。
(5)某厂测知合成塔中甲酸钠生产产率为40%,要制得溶质质量分数为5%的HCOONa溶液1吨,需要CO在标况下的体积为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香豆素﹣4是一种激光染料,应用于可调谐染料激光器。香豆素﹣4由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述正确的是( )
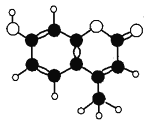
① 分子式为C10H9O3 ② 能与Br2水发生取代反应
③能与Br2水发生加成反应 ④能使酸性KMnO4溶液褪色
⑤ 1mol香豆素﹣4最多能与2molNaOH的溶液反应
A.①②③B.③④⑤C.②③④D.②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机结构理论认为:有机化合物分子中,基团之间是相互影响的,从而导致同种基团的化学性质不同。以下事实中,不能说明此观点的是( )
A.乙酸能与![]() 溶液反应放出气体,而乙醇不能
溶液反应放出气体,而乙醇不能
B.乙烯能使酸性![]() 溶液褪色,而甲烷不能
溶液褪色,而甲烷不能
C.甲苯能使酸性![]() 溶液褪色,而乙烷不能
溶液褪色,而乙烷不能
D.苯硝化反应一般生成一硝基苯,而甲苯硝化反应生成三硝基甲苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物W用作调香剂、高分子材料合成的中间体等,制备W的一种合成路线如下。

已知:![]() +CH3Cl
+CH3Cl![]() +HCl
+HCl
请回答下列问题:
(1)F的化学名称是__,②的反应类型是___。
(2)D中含有的官能团是__(写名称),D聚合生成高分子化合物的结构简式为___。
(3)反应③的化学方程式是___。
(4)反应⑥的化学方程式是___。
(5)芳香化合物N是A的同分异构体,其中核磁共振氢谱为三组峰的结构简式为___。
(6)参照有机物W的上述合成路线,设计以M为起始原料制备F的合成路线(无机试剂任选)___。
[示例:CH3CH2OH![]() CH2=CH2
CH2=CH2![]() BrCH2CH2Br]
BrCH2CH2Br]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近浙江大学成功研制出具有较高能量密度的新型铝一石墨烯(Cn)电池(如图)。该电池分别以铝、石墨烯为电极,放电时电池中导电离子的种类不变。已知能量密度=电池容量(J)÷负极质量(g)。下列分析正确的是
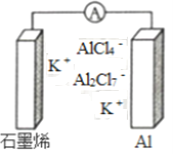
A. 放电时,Cn(石墨烯)为负极
B. 放电时,Al2Cl7-在负极转化为AlCl4-
C. 充电时,阳极反应为4 Al2Cl7-+3e-=A1+7AlCl4-
D. 以轻金属为负极有利于提高电池的能量密度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得推论正确的是
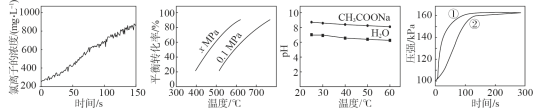
A.甲是新制氯水光照过程中氯离子浓度的变化曲线,推断次氯酸分解生成了HCl和O2
B.乙是C4H10(g)![]() C4H8(g)+H2(g)的平衡转化率与温度和压强的关系曲线,推断该反应的H>0、x>0.1
C4H8(g)+H2(g)的平衡转化率与温度和压强的关系曲线,推断该反应的H>0、x>0.1
C.丙是0.5mol/L CH3COONa溶液及水的pH随温度的变化曲线,说明随温度升高,CH3COONa溶液中c(OH-)减小
D.丁是0.03g镁条分别与2mL 2mol/L盐酸和醋酸反应过程中密闭容器内气体压强随时间的变化曲线,推断①代表盐酸与镁条的反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com