
 (1)已知在常温常压下:
(1)已知在常温常压下:分析 根据盖斯定律,将①-②+③×3可得④,由此可计算△H2,以此解答该题.
解答 解:已知①CH3CH2OH(l)+3O2(g)?2CO2(g)+3H2O(g)△H1=-1366kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H2
③H2O(g)=H2O(l)△H3=-44kJ•mol-1
④CH3CH2OH(l)+2O2(g)?2CO(g)+3H2O(l)△H4=-932kJ•mol-1,
利用盖斯定理,将①-②+③×3可得④,则
(-1366kJ•mol-1)-(△H2)+(-44kJ•mol-1)×3=-932kJ•mol-1,
则△H2=-566kJ•mol-1,
则 CO的燃烧热△H=-283kJ•mol-1,
故答案为:-283kJ•mol-1.
(2) (2分)
(2分)
点评 本题考查了化学反应与能量、盖斯定律,为高频考点,侧重于学生的分析、计算能力的考查,题目难度中等,注意把握盖斯定律的含义及其应用方法.


科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小顺序:W>X>Y | |
| B. | W的简单气态氢化物的热稳定性比Y的弱 | |
| C. | Z分别与Q、X形成的化合物中化学键类型相同 | |
| D. | X的最高价氧化物对应水化物的碱性在同周期中最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14 g乙烯气体中的氢原子数约为2×6.02×1023 | |
| B. | 标准状况下,2.24 L H2O含有的共价键数约为0.2×6.02×1023 | |
| C. | 1 mol N2与3 mol H2反应生成的NH3分子数约为2×6.02×1023 | |
| D. | 0.1 L 0.5 mol/L CH3COOH溶液中含有的氢离子数约为0.05×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中滴入氯水,然后滴入少量的KSCN溶液,溶液变红色 | 原溶液中一定含有Fe3+ |
| B | 向某溶液中加入足量的盐酸无明显现象,再加入BaCl2溶液,产生白色沉淀 | 原溶液中一定含有SO42- |
| C | 向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色无味气体 | 原溶液中一定含有CO32- |
| D | 向某溶液中滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口,试纸不变蓝 | 原溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,2.24 LC2H4和C2H2的混合气体中含碳原子数目小于0.2 NA | |
| B. | 100 mL 1.0 mol/L FeCl3溶液与足量Cu反应,转移的电子数为0.2 NA | |
| C. | 标况下44.8 mL氯气通入足量水中发生反应,转移电子数为2×10-3NA | |
| D. | 常温下,pH=2的H2SO4溶液中含有的H+数目为0.02 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14g乙烯和丙烯混合气体中的氢原子数为2NA | |
| B. | 7.8g Na2S固体和7.8g Na2O2固体中含有的阴离子数目均为0.1NA | |
| C. | 标准状况下,5.6L二氧化碳气体中含有的氧原子数目为0.5NA | |
| D. | 0.5mol/LHCl 溶液中含有的氢离子数为0.05NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+为重金属离子,故CuSO4不能用于生活用水消毒 | |
| B. | 卤水煮豆腐是Mg2+、Ca2+等使蛋白质胶体发生凝聚过程 | |
| C. | 纯碱溶液可以洗涤餐具上的油渍 | |
| D. | 油漆刷在钢铁护栏表层用来防止金属锈蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 方案 | 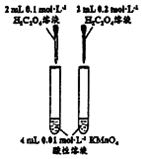 |  | 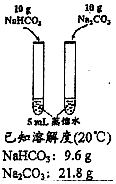 |  |
| 目的 | 探究浓度对化学反应速率的影响 | 制备氨气 | 室温下比较NaHCO3和Na2CO3的溶解度 | 探究温度对化学平衡的影响 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com