
下列溶液中有关微粒的物质的量浓度关系正确的是
A.在醋酸钠溶液中:c(CH3COOH) = c(OH-) - c(H+)
B.等体积等物质的量浓度的NaCl和NaClO溶液中离子总数:N前<N后
C.1mol•L-1的(NH4)2Fe(SO4)2•6H2O溶液中:c(NH4+)=c(SO42-)>c(Fe2+)>c(H+)
D.0.1 mol•L-1NaHX溶液pH=3,则此溶液中:c(HX-)>c(H2X)>c(X2-)
A
【解析】
试题分析:A.醋酸钠是强碱弱酸盐,水解使溶液显碱性C(OH-)=C(H+)(开始)= C(H+)(剩余)+ C(H+)(消耗)= c(H+)+ c(CH3COOH)。所以c(CH3COOH) = c(OH-) - c(H+)。正确。B.等体积等物质的量浓度的NaCl和NaClO,即二者的物质的量相等。混合后对NaClO溶液起到了稀释作用。由水解的离子方程式ClO-+H2O 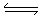 HClO+OH-可看出混合前后溶液中离子总数不变。错误。C.电离方程式为:(NH4)2Fe(SO4)2=2NH4++Fe2++2
SO42-. NH4+发生水解反应NH4++H2O
HClO+OH-可看出混合前后溶液中离子总数不变。错误。C.电离方程式为:(NH4)2Fe(SO4)2=2NH4++Fe2++2
SO42-. NH4+发生水解反应NH4++H2O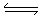 NH3·H2O+H+。所以在溶液中:c(SO42-)>c(NH4+)。尽管Fe2+发生水解消耗,但盐电离产生的离子Fe2+比弱电解质水电离产生的离子H+浓度大。所以c(Fe2+)>c(H+)。故离子浓度的大小顺序是c(SO42-)>c(NH4+)>
c(Fe2+)>c(H+)。错误。D. 在溶液中电离HX-
NH3·H2O+H+。所以在溶液中:c(SO42-)>c(NH4+)。尽管Fe2+发生水解消耗,但盐电离产生的离子Fe2+比弱电解质水电离产生的离子H+浓度大。所以c(Fe2+)>c(H+)。故离子浓度的大小顺序是c(SO42-)>c(NH4+)>
c(Fe2+)>c(H+)。错误。D. 在溶液中电离HX-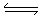 H++X2-使溶液显酸性,HX-+H2O
H++X2-使溶液显酸性,HX-+H2O 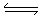 H2X
+OH-使溶液显碱性。由于0.1 mol•L-1NaHX溶液pH=3,则由此可确定HX-的电离大于水解。故此溶液中:c(HX-)> c(X2-) >c(H2X)。错误。
H2X
+OH-使溶液显碱性。由于0.1 mol•L-1NaHX溶液pH=3,则由此可确定HX-的电离大于水解。故此溶液中:c(HX-)> c(X2-) >c(H2X)。错误。
考点:考查溶液中有关微粒的物质的量浓度关系的知识。


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com