
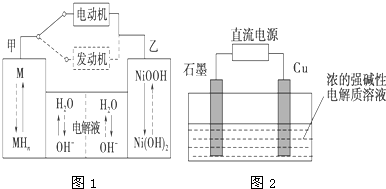
 运用相关原理,回答下列问题:
运用相关原理,回答下列问题:| 1 |
| 2 |
| 3 |
| 2 |
| 放电 |
| 充电 |
| ||
| 1 |
| 2 |
| 3 |
| 2 |
| ||


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
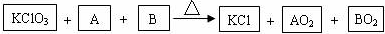
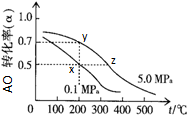
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学反应的反应热不仅与反应体系的始态和终态有关,也与反应的途径有关 |
| B、盖斯定律遵守能量守恒定律 |
| C、利用盖斯定律可间接计算通过实验难测定的反应的反应热 |
| D、利用盖斯定律可以计算有副反应发生的反应的反应热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
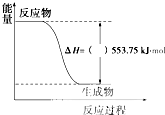 (1)许多运动会使用的火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题:
(1)许多运动会使用的火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题:| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
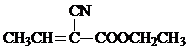 )是合成某种手术用粘合剂的单体,X的合成路线如下:
)是合成某种手术用粘合剂的单体,X的合成路线如下: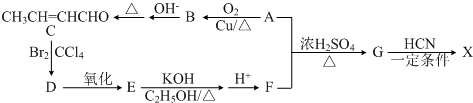

查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、产生的淡黄色沉淀为AgI |
| B、产生的黄色沉淀为AgBr |
| C、由上述实验现象可说明溶解度S(AgBr)>S(AgI)>S(AgCl) |
| D、上述实验理解说明沉淀可相互转化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com