
| ���� | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | NaAlO2 |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
| 1 |
| 3 |
| c(HCN)��c(OH-) |
| c(CN-) |
| c(CN-)��c(H+) |
| c(HCN) |
| Kw |
| Ka |
| 1��10-14 | ||
|


 ȫ�ܲ��һ���þ�ϵ�д�
ȫ�ܲ��һ���þ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��δϴ���ձ��Ͳ����� |
| B���ܽ���ȵ�δ��ȴ����������ƿ |
| C������ʱ��������ƿ�̶��� |
| D����Һʱ�������¶˿��ڿ̶���֮�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ��� | ʵ����� | ʵ������ | ��������� |
| A | ����ˮ�Ҵ���Ũ���ᰴ�������1��3������ƿ��Ѹ�ټ��ȵ�170�棬�����ɵ�����ͨ�����Ը��������Һ | ��ƿ����Һ����ɫ�����ɫ������Ϊ��ɫ������������ʹKMnO4��Һ��ɫ | �Ҵ�������ȥ��Ӧ�������к�����ϩ |
| B | ������Һ��ϡH2SO4��ϼ���һ�ᣬ��ȴ��μ�NaOH�����ԣ��ټ����Ƶ�Cu��OH��2����Һ��Ϻ���������� | �к�ɫ�������� | ������ȫˮ���ˣ���ˮ������л�ԭ�� |
| C | �ֱױ��ͼ������ʢ���������Ը��������Һ�У������ | �Ӽױ����Թ���Һ��ɫ��ȥ�����뼺����Թ���Һ��ɫû����ɫ | �ױ��еļ����Ա����Ը�����������������еIJ��ܣ��л��������ԭ�ӣ��ţ�����Ӱ��ᵼ�����ʻ�ѧ���ʵIJ�ͬ |
| D | ��ij±�����μӵ�������NaOH��Һ�г����Ȼ���ٵμӼ�����������Һ | �а�ɫ�������� | ��±���������ȴ��� |
| A��A | B��B | C��C | D��D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
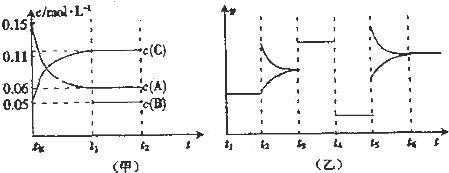
| A����Ӧ�ķ���ʽΪ3A��g��+B��g��?2C��g�� |
| B��t3��t4��t4��t5��t5��t6���ο��ܸı����������Ϊ���Ӵ��������ͷ�Ӧ�¶ȣ�����ѹǿ |
| C��B����ʼ���ʵ���Ϊ0.08mol |
| D����t1=10s��A��t0��t1ʱ��εķ�Ӧ����Ϊ0.00225mol?L-1?s-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com