
【题目】.某同学利用下列实验探究金属铝与铜盐溶液反应:

下列说法正确的是
A. 由实验1可以得出结论:金属铝的活泼性弱于金属铜
B. 溶液中阴离子种类不同是导致实验1、2出现不同现象的原因
C. 实验2中生成红色物质的离子方程式:Al+Cu2+→Al3++Cu
D. 由上述实验可推知:用砂纸打磨后的铝片分别与c(H+)均为0.2 mol/L的盐酸和硫酸反应,后者更剧烈
【答案】B
【解析】
A项,根据实验2即可推翻由实验1得到的结论;B.溶液中阳离子均为铜离子,阴离子分别为氯离子和硫酸根离子,阴离子种类不同导致实验现象不同;C.方程式没有配平;D.含有氯离子的铜盐与铝反应剧烈。
A项,实验1虽然没有明显现象,但并不能说明铝的活泼性弱于铜,只能说明试管1内没有反应发生,再结合实验2即可推翻仅由实验1得到的结论,故A项错误;B项,由图中实验1和实验2对比可知,两者之间唯一的变量就是阴离子种类不同,因此阴离子种类不同就是实验现象不同的原因,故B项正确;C项,方程式未配平,应为:2Al+3Cu2+=2Al3++3Cu,故C项错误;D项,c(H+)均为0.2 mol/L的盐酸和硫酸,由B项分析可知氯离子会促进铝的反应,因此前者更剧烈,故D项错误;正确选项B。


科目:高中化学 来源: 题型:
【题目】氢氧化镁作为水处理剂处理含Fe3+、Cr3+、Pb2+的酸性废水过程中,涉及到的化学反应类型有
A. 氧化还原反应
B. 分解反应
C. 中和反应
D. 化合反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 常温下醋酸分子不可能存在于pH>7的碱性溶液中
B. 常温下pH=2的H2SO4与pH=13的NaOH溶液混和,所得混和液的pH=11,则H2SO4溶液与NaOH溶液的体积比是9:1
C. 0.1mol/L硫化钠溶液中,c(S2-)+c(HS-)+2c(H2S)=0.1mol/L
D. 常温下向氯化铵溶液中加入少量氨水使溶液的pH=7,则混合溶液中c(NH4+)>c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中都正确的选项是 ( )
①用剩的药品为避免浪费应放回原瓶
②蒸发氯化钠溶液时要用玻璃棒不断搅拌
③称取易潮解的药品必须放在玻璃器皿中称量
④浓硫酸的稀释时,将水沿烧杯内壁缓缓倒入,并不断搅拌
A.②③B.②③④C.②④D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示一个化学反应过程,图中的黑球表示两个相同的单糖或其单元。
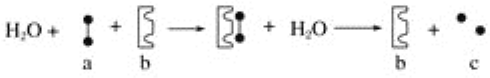
则图中的a、b、c分别表示( )
A. 麦芽糖 麦芽糖酶 葡萄糖
B. 蔗糖 蔗糖酶 果糖
C. 乳糖 乳糖酶 葡萄糖
D. 淀粉 淀粉酶 葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:将Cl2通入适量NaOH溶液,产物中可能有NaCl、NaClO、NaClO3,且![]() 的值与温度高低有关。当n(NaOH)=a mol时,下列有关说法错误的是
的值与温度高低有关。当n(NaOH)=a mol时,下列有关说法错误的是
A. 参加反应的氯气的物质的量等于a/2 mol
B. 改变温度,产物中NaClO3的最大理论产量为a/7 mol
C. 改变温度,反应中转移电子的物质的量ne的范围:a/2 mol≤ne≤5a/6 mol
D. 若某温度下,反应后![]() =11,则溶液中
=11,则溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示。常温下,B、E 为气态,分别呈黄绿色、无色,且 E 常 用作制冷剂。D 是最常见的无色液体,F 是一种不溶于水的碱,G 是厨房中的常见调味品,H 为硝酸盐, 其摩尔质量为 80 g·mol-1。

(1)F、H 的化学式分别为___ 、___ 。
(2)请设计检验 A 中阳离子的实验方案:___ 。
(3)写出反应①的离子方程式:___。
(4)写出反应②的化学方程式,并标出电子转移的数目和方向:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于甲烷及其反应产物的叙述中正确的是
A. 甲烷分子中的H-C-H键的键角为90°B. CH2Cl2具有正四面体结构
C. CHCl3只代表一种物质D. CH2Br2可能有两种结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com