
 ��
��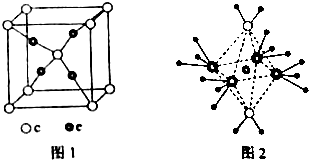
���� ���ڱ�ǰ�����ڵ�Ԫ��a��b��c��d��e��ԭ��������������a�ĺ����������������������ͬ����a��HԪ�أ�c������������Ϊ���ڲ��������3����ԭ������������������8����c����2�����Ӳ㣬����㺬��6�����ӣ�ΪOԪ�أ�d��cͬ�壬��d��SԪ�أ�b�ļ۵��Ӳ��е�δ�ɶԵ�����3������ԭ������С��c����b��NԪ�أ�e�������ֻ��һ�����ӣ����������18�����ӣ���e��CuԪ�أ��ٽ��ԭ�ӽṹ�����ʽṹ��Ԫ��������֪ʶ���
��� �⣺���ڱ�ǰ�����ڵ�Ԫ��a��b��c��d��e��ԭ��������������a�ĺ����������������������ͬ����a��HԪ�أ�c������������Ϊ���ڲ��������3����ԭ������������������8����c����2�����Ӳ㣬����㺬��6�����ӣ�ΪOԪ�أ�d��cͬ�壬��d��SԪ�أ�b�ļ۵��Ӳ��е�δ�ɶԵ�����3������ԭ������С��c����b��NԪ�أ�e�������ֻ��һ�����ӣ����������18�����ӣ���e��CuԪ�أ�
��1��b��c��d�ֱ���N��O��SԪ���У�Ԫ�صķǽ�����Խǿ�����һ������Խ��ͬһ����Ԫ���У���һ����������ԭ��������������������ƣ�����VA��Ԫ�ش�������Ԫ�أ�����N��O��S�е�һ������������NԪ�أ�
eΪCuԪ�أ�e�ļ۲�Ϊ3d��4s���ӣ���۲���ӹ��ʾͼΪ�� ��
��
�ʴ�Ϊ��N�� ��
��
��2��a��HԪ�أ�a������Ԫ���γɵĶ�Ԫ���ۻ������У����ӳ������Σ��÷���Ϊ���������������е�ԭ�Ӻ���3�����ۼ���һ���µ��Ӷԣ����Ը÷��ӵ�����ԭ�ӵ��ӻ���ʽΪsp3��
�����мȺ��м��Թ��ۼ����ֺ��зǼ��Թ��ۼ��Ļ������ǣ�H2O2��N2H4��
�ʴ�Ϊ��sp3��H2O2��N2H4��
��3��5��Ԫ���У�ֻ��N��S���ں����ᣬN��SԪ���γɵĺ������У�HNO2 HNO3��H2SO3��H2SO4��
NO2-��Nԭ�Ӽ۲���Ӷ�����2+$\frac{5+1-2��2}{2}$=3����1�Թµ��Ӷԣ�ΪV�νṹ��
NO3-��Nԭ�Ӽ۲���Ӷ�����3+$\frac{5+1-2��3}{2}$=3�������µ��Ӷԣ�Ϊƽ�������Σ�
SO32-��Nԭ�Ӽ۲���Ӷ�����3+$\frac{6+2-2��3}{2}$=4����1�Թµ��Ӷԣ�Ϊ�����Σ�
SO42-��Nԭ�Ӽ۲���Ӷ�����4+$\frac{6+2-2��4}{2}$=4�������µ��Ӷԣ�Ϊ�������壻
�ʴ�Ϊ��HNO2��HNO3��H2SO3��
��4���þ�����c���Ӹ���=1+8��$\frac{1}{8}$=2��e���Ӹ���4���þ����������Ӻ�ͭ���Ӹ���֮��=2��4=1��2����e��c�γɵ�һ�����ӻ����ﻯѧʽΪCu2O������e���ӵĵ��Ϊ+1
�ʴ�Ϊ��+1��
��5����5��Ԫ���γɵ�һ��1��1�����ӻ������У������ӳ�������ṹ��˵�������ӵ�����ԭ�Ӽ۲���ӶԸ�����4�Ҳ����µ��Ӷԣ�Ϊ��������ӣ������ӳ����������İ�����ṹ����ͼ2��ʾ��������ͼ��֪�������ӵ���λ����6���������к��й��ۼ�����λ���������Ӹ�����4��ˮ���Ӹ�����2���仯ѧʽΪ[Cu��NH3��4��H2O��2]SO4��H2O��Cu2+����λ����NH3��Cu2+���������Ըû��������ʱ����ʧȥ�������H2O��
�ʴ�Ϊ��SO42-�����ۼ�����λ����H2O��H2O��Cu2+����λ����NH3��Cu2+������
���� ���⿼����λ�á��ṹ�����ʹ�ϵ���ۺ�Ӧ�ã�Ϊ�߿��ȵ㣬��Ŀ�Ѷ��еȣ��漰ԭ�Ӻ�������Ų���λ�ýṹ�����ʵĹ�ϵ����ѧ���Ĺ�������֪ʶ���ѵ��ǣ�5������ȷ�˽�ͼ�б�ʾ�����ǽⱾ��ؼ�����ȷ����λ�����γɵĻ�ѧ��������֪ʶ��϶࣬��ֿ���ѧ���ķ������������������Ӧ��������


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
 ���ᾧ�����ɿ���H2C2O4•xH2O��ʾ��Ϊ�˲ⶨxֵ����������ʵ�飺��ȡWg���ᾧ�壬���100mLˮ��Һ����ȡ25.00mL�����ƵIJ�����Һ������ƿ�ڣ���������ϡH2SO4����Ũ��Ϊamol•L-1��KMnO4��Һ�ζ����������ķ�Ӧ��KMnO4+H2C2O4+H2SO4=K2SO4+CO2��+MnSO4+H2O
���ᾧ�����ɿ���H2C2O4•xH2O��ʾ��Ϊ�˲ⶨxֵ����������ʵ�飺��ȡWg���ᾧ�壬���100mLˮ��Һ����ȡ25.00mL�����ƵIJ�����Һ������ƿ�ڣ���������ϡH2SO4����Ũ��Ϊamol•L-1��KMnO4��Һ�ζ����������ķ�Ӧ��KMnO4+H2C2O4+H2SO4=K2SO4+CO2��+MnSO4+H2O�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | HCN | B�� | CH3COOH | C�� | HNO2 | D�� | HF |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | NH3•H2O��Һ��c��OH-����NaOH��Һ��c��OH-�� | |
| B�� | c��Na+��=c��NH4+�� | |
| C�� | ��������������ƺͰ�ˮ��Һ������������ȫ��Ӧ��NaOH���ĵ���������� | |
| D�� | ����������������ƺͰ�ˮ��Һ��ˮϡ����ͬ������NaOH��Һ��pH�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢� | B�� | �٢� | C�� | �٢� | D�� | �ۢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Q2��Q1��57.3 | B�� | Q1=57.3��Q2 | C�� | Q2��57.3��Q1 | D�� | Q2=57.3��Q1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ũ���� | B�� | ���� | C�� | ��ˮ | D�� | ϡ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
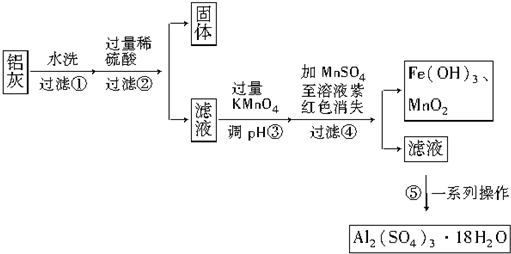
| Al��OH��3 | Fe��OH��2 | Fe��OH��3 | |
| ��ʼ����ʱ | 3.4 | 6.3 | 1.5 |
| ��ȫ����ʱ | 4.7 | 8.3 | 2.8 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ��� | ��ѹ/V | �������� | ������������ |
| �� | x��a | �缫�������ֻ�ɫ�������ݲ��� | ��Fe3+����Cl2 |
| �� | a��x��b | �缫�������ֻ�ɫ�������ݲ��� | ��Fe3+����Cl2 |
| �� | b��x��0 | �����Ա仯 | ��Fe3+����Cl2 |
| ��� | ��ѹ/V | �������� | ������������ |
| �� | a��x��c | �����Ա仯 | ��Cl2 |
| �� | c��x��b | �����Ա仯 | ��Cl2 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com