
(12分)要除去下表所列有机物中的杂质(括号内为杂质),从(Ⅰ)中选择适宜的试剂,从(Ⅱ)中选择分离提纯的方法,用序号填入表中。
(1)试剂:a.浓硫酸 b.氢氧化钠 c.生石灰 d.碳酸钠 e.水 f.浓溴水
(2)方法:A.过滤 B.分液 C.蒸馏
| 要提纯的物质 (杂质) | 溴乙烷 (乙醇) | 乙醇 (水) | 乙醇 (乙酸) | 溴苯 (溴) | 苯 (苯酚) |
| (1)选用试剂 | | | | | |
| (2)分离方法 | | | | | |
本题共12分。(1)、(2)每空1分
(3)分液漏斗(1分)、烧杯(1分)要提纯的物质(杂质) CH3CH2Br
(C2H5OH)C2H5OH
(H2O)CH3CH2OH
(CH3COOH)C6H5Br
(Br2)C6H6
(C6H5OH)(1)选用试剂 e c b、c或d b b或d (2)分离方法 B C C B B
解析试题分析:溴乙烷中的乙醇用水除去,因为乙醇与水互溶,但溴乙烷不溶于水,然后用分液的方法分离;乙醇中的水用生石灰除去,因为生石灰与水反应生成氢氧化钙,然后蒸馏分离;乙醇中的乙酸用氢氧化钠、生石灰、碳酸钠均可除去,因为乙酸与这三种物质都反应,乙醇不反应,然后蒸馏分离;溴苯中的溴用氢氧化钠除去,因为溴与氢氧化钠反应,溴苯不与氢氧化钠反应,且溴苯不溶于水,然后分液分离;苯酚与氢氧化钠或碳酸钠都反应,所以苯中的苯酚用氢氧化钠或碳酸钠除去,然后分液分离;
(3)分液的操作中用到的主要玻璃仪器是分液漏斗和烧杯。
考点:考查有机物的除杂,分液操作的仪器的判断


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2013-2014广西桂林市、崇左市、防城港市、北海市高三化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A、pH=1的溶液:Fe2+、NO3-、SO42-、Na+
B、c(H+)/c(OH-)=1012的溶液:NH4+、Al3+、NO3-、Cl-
C、c(Fe3+)=0.1 mol·L-1的溶液:K+、ClO-、SO42-、SCN-
D、水电离的c(H+)=l×10-14mol·L-1的溶液:Ca2+、K+、Cl-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
化学已经渗透到人类生活的各个方面,下列说法不正确的是
| A.食盐可作氯碱工业的原料 |
| B.碘酒是指单质碘的乙醇溶液 |
| C.大量使用化肥和农药,以提高农作物产量,符合绿色化学的原则 |
| D.低碳生活注重节能减排,尽量使用太阳能灯代替化石燃料,减少温室气体的排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某实验小组用0.55 mol/L NaOH溶液和0.50 mol/L盐酸反应来测定中和热,实验装置如下图所示。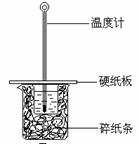
(1)图示实验装置中缺少的一种仪器是 ,大、小烧杯间填满碎纸条的作用是 。
(2)取50 mL NaOH溶液和50mL盐酸进行实验,实验数据如下表:
①请填写下表中的空白:
| 温度 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.1 | 3.0 |
| 2 | 25.9 | 25.9 | 25.9 | 28.8 | |
| 3 | 26.4 | 26.2 | 26.3 | 29.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)科学家根据体系存在着力图使自身能量趋于 和由 变为 的自然现象,提出了互相关联的 判据和 判据,为最终解决“反应进行的方向”这一问题提供了必要的依据。
(2)在密闭条件下,体系有有序自发地转变为无序的倾向,因为与有序体系相比,无序体系更加稳定,科学家把这种因素称作 。
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
(12分)一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。从废料中回收氧化钴(CoO)的工艺流程如下: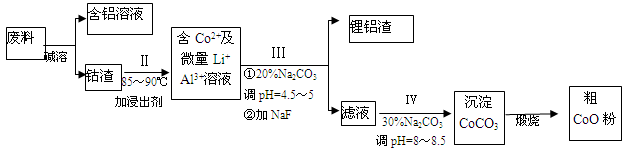
(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 。
(2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液,加入Na2S2O3的作用是___________。在实验室模拟工业生产时,也可用盐酸代替酸化的Na2S2O3,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴的主要原因_________。
(3)用离子方程式表示过程Ⅳ中Na2CO3的主要作用_______。
(4)下图是CoCl2·6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,B物质的化学式是______。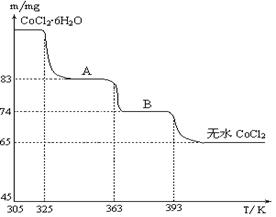
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
下表为元素周期表的一部分,参照元素①~⑦在表中的位置
请用相关的化学用语回答下列问题:
| 族 周期 | IA | | 0 | |||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | | | ② | ④ | |
| 3 | ⑤ | | ③ | | | ⑥ | ⑦ | |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com