
分析 I、(1)取1.2g C跟8.0g CuO混合加热,生成的气体应为碳的氧化物,即可能为二氧化碳和一氧化碳,将反应生成的气体通过足量的澄清石灰水后还可收集到气体,则生成物为一定有一氧化碳,沉淀为碳酸钙,说明有二氧化碳生成,根据碳元素守恒进行计算和判断;
(2)根据题意可知结合(1)的判断可知,反应后得到的固体应包含反应剩余的碳,生成的铜及Cu2O,根据碳元素和铜元素守恒可计算出剩余的碳和生成的铜的质量,根据氧元素守恒可计算出反应后生成的固体中所含有的氧元素的物质的量,进而确定Cu2O的质量,据此答题;
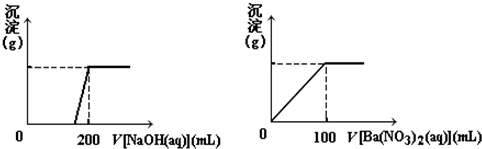
Ⅱ、(3)X是由Cu、Fe、S三种元素组成的复盐,所以该盐的质量就是各种元素的总质量和,由图象数据,氢氧化钠先中和酸,然后将铜离子、铁离子沉淀,据此来回答;
(4)根据物质相对分子质量的计算来回答.
解答 解:I、(1)沉淀为碳酸钙,其质量为2.5g,则碳酸钙中含有碳元素的物质的量为$\frac{2.5}{100}$mol=0.025mol,收集到560mL气体应为CO,其物质的量为$\frac{0.56}{22.4}$mol=0.025mol,所以生成物中共有碳元素的物质的量为0.025mol+0.025mol=0.05mol,而实验中取用了1.2g C,即为0.1mol,所以碳不完全参加反应,
故答案为:不完全;CO;
(2)根据题意可知结合(1)的计算可知,n(CO2)=n(CO)=0.025mol,所以n(O)=0.075mol0,在8.0g CuO中n(O)=$\frac{8.0}{80}$mol=0.1mol,所以Cu2O中n(O)=0.1mol-0.075mol=0.025mol,则n(Cu2O)=0.025mol,m(Cu2O)=0.025mol×144g/mol=3.6g,剩余碳的质量为1.2g-0.05mol×12g/mol=0.6g,生成铜的质量为64g/mol×($\frac{8.0}{80}$mol-0.025mol×2)=3.2g,所以反应后得到的固体混合物总质量为3.2g+3.6g+0.6g=7.4g,
故答案为:7.4g;0.025;
Ⅱ、(3)依题意,Cu、Fe两种元素的质量比为8:7,则m g X中:n(Cu):n(Fe)=$\frac{8}{64}$:$\frac{7}{56}$=1:1,当加水稀释至 2.12 L时测得其pH为0,此是氢离子浓度为1mol/L,根据图示数据,氢氧化钠先中和氢离子,然后将金属离子转化为沉淀,所以2n(Cu2+)+3n(Fe3+)=6.05mol•L-1×0.2L×2-1mol•L-1×2.12L,
故:n (Cu)=n (Fe)=0.06mol,n (S)=0.600mol•L-1×0.1L×2=0.12mol,
因此mg=m(Cu)+m(Fe)+m(S)=0.06mol×64g•mol-1+0.06mol×56g•mol-1+0.12mol×32g•mol-1=11.04g,即m的值为11.04.
答:m的值为11.04;
(4)根据(3)的计算可知,n (Cu)=n (Fe)=0.06mol,n (S)=0.600mol•L-1×0.1L×2=0.12mol,即n (Cu):n (Fe):n (S)=1:1:2,所以可设X的化学式为(CuFeS2)n,则(64+56+32×2)×n=368,解得:n=2,所以X的化学式为Cu2Fe2S4.
故答案为:Cu2Fe2S4.
点评 本题考查学生确定复杂化学式的计算方法,结合图象知识考查,增加了难度,要求学生具有分析和解决问题的能力,答题时注意元素守恒思想的灵活运用.


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:实验题
 中和热是在稀溶液中,酸和碱反应生成1mol水所放出的热量.某同学利用50mL 0,.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和热测定的实验,回答下列问题:
中和热是在稀溶液中,酸和碱反应生成1mol水所放出的热量.某同学利用50mL 0,.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和热测定的实验,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ④⑥ | C. | ①④⑥ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 由铜片、锌片和200ml稀H2SO4组成的原电池中,一段时间后某极产生3.36L(标准状况)的气体.
由铜片、锌片和200ml稀H2SO4组成的原电池中,一段时间后某极产生3.36L(标准状况)的气体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.7 g的2H35Cl含质子数为1.9NA | |
| B. | 16 g O3和O2混合物中氧原子数为NA | |
| C. | 100 mL 1 mol•L-1AlCl3溶液中含的阳离子数等于0.1NA | |
| D. | 标准状况下,33.6 L氯气与28 g铁充分反应,转移的电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com