
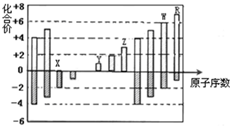
 如图所示是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
如图所示是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )| A、原子半径:Z>Y>X |
| B、气态氢化物的还原性:W>R |
| C、WX3和水反应形成的化合物是离子化合物 |
| D、含Z的盐溶液一定显示酸性 |


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
| A、在FeBr2溶液中通入足量氯气:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | ||||
B、用石墨电极电解氯化镁溶液:2Cl-+2H2O
| ||||
| C、向CaCl2溶液中通入CO2气体:Ca2++CO2+H2O═CaCO3↓+2H+ | ||||
| D、等物质的量浓度的小苏打溶液和石灰水按体积比3:2混合:3HCO3-+2Ca2++3OH-═2CaCO3↓+CO32-+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
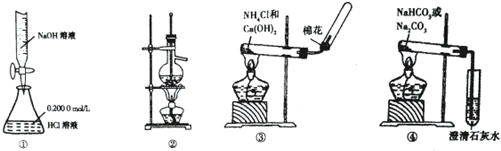
| A、用图①所示装置测定NaOH的浓度 |
| B、用图②所示装置分馏少量石油 |
| C、用图③所示装置在实验室制备收集氨气 |
| D、用图④所示装置鉴别碳酸钠和碳酸氢钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、制氧气时,用Na2O2或H2O2作反应物可选择相同的气体发生装置 |
| B、制氯气时,用饱和NaHCO3溶液和浓硫酸净化气体 |
| C、制乙烯时,用排水法或向上排空气法收集气体 |
| D、制二氧化氮时,用水或NaOH溶液吸收尾气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、硫酸氢铵溶液与足量氢氧化钠溶液反应:NH4++OH-
| ||||
B、将饱和FeCl3溶液滴入沸水中制备胶体:Fe3++3H2O
| ||||
| C、Fe2O3固体溶于过量氢碘酸溶液中:Fe2O3+6H+═2Fe3++3H2O | ||||
| D、苯酚钠溶液中通入少量的CO2:2C2H5O-+CO2+H2O→2C2H5OH+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
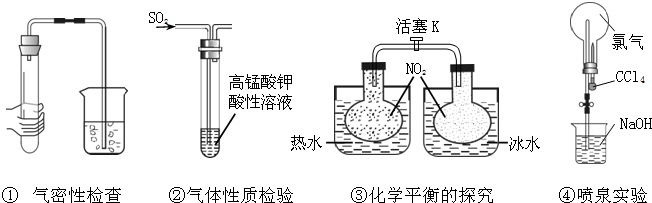
| 选项 | 现象 | 结论 |
| A | ①中导管口冒气泡,手松开无现象 | 气密性良好 |
| B | ②中KMnO4溶液紫红色褪去 | SO2具有漂白性 |
| C | ③中关闭K,气体颜色在热水中比冷水深 | NO2生成N2O4为吸热反应 |
| D | ④中烧瓶中形成喷泉 | Cl2易溶于CCl4 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验内容 | 实验目的 | |
| A | 将SO2通入酸性KMnO4溶液中,紫色褪去 | 证明SO2具有漂白性 |
| B | 向滴有酚酞的Na2CO3溶液中加入BaCl2溶液,红色褪去 | 证明Na2CO3溶液中存在水解平衡 |
| C | 向FeCl3和CuCl2混合溶液中加入铁粉,有红色固体析出 | 证明氧化性:Cu2+>Fe3+ |
| D | 向Na2SiO3溶液中滴入酚酞,溶液变红,再滴加稀盐酸,溶液红色变浅直至消失 | 证明非金属性:Cl>Si |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
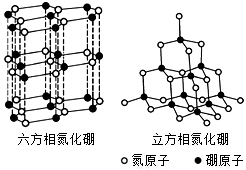 氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.
氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| 主族 周期 |
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| 四 | ⑧ | ⑨ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com