
下列叙述中,正确的是
A.1 mol 过氧化钠中阴离子所带的负电荷数为NA
B.14 g乙烯和丙烯的混合物中含有的碳原子的数目为NA
C.28 g C16O与28 g C18O中含有的质子数均为14 NA
D.标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为2 NA
 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源:2016-2017学年江苏省无锡江阴市四校高二上期中化学试卷(解析版) 题型:选择题
有机化学主要研究有机化合物所发生的反应,下列化合物中不是有机物的是
A、CO2 B、C2H6 C、HCHO D、CH3OH
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市武清区等五区县高三上学期期中考试化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A.普通锌锰干电池中的MnO2在工作时起催化作用
B.lmol Na2O2与足量水反应产生O2,理论上转移的电子数约为2×6.02×1023
C.室温下,体积、pH均相同的HA和HB两种一元酸分别与足量的锌反应,HA放出氢气多,说明酸性:HB>HA
D.恒温恒压密闭容器中反应N2(g)+3H2(g) 2NH3(g)ΔH=-a kJ·mol-1达到平衡时,向容器中再充入一定量NH3, 重新达平衡时a值减小
2NH3(g)ΔH=-a kJ·mol-1达到平衡时,向容器中再充入一定量NH3, 重新达平衡时a值减小
查看答案和解析>>
科目:高中化学 来源:2016-2017学年北京五十六中九高三上学期期中考试化学试卷(解析版) 题型:填空题
碳酸钠是一种重要的化工产品,利用氨碱法生产纯碱的流程如下图所示。
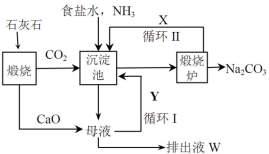

(1)沉淀池中发生反应的化学方程式为___________________;
(2)X是________,Y是_______(填化学式);
(3)排出液W中的溶质除了氢氧化钙外,还有_______、________;(至少两种)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年北京五十六中九高三上学期期中考试化学试卷(解析版) 题型:选择题
抗禽流感药物达菲可用莽草酸为原料来合成。莽草酸结构简式如图所示。下列说法正确的是
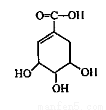
A.莽草酸的化学式为C7H6O5
B.1mol莽草酸最多能和4molNaOH发生反应
C.莽草酸分子中所有碳原子共平面
D.莽草酸在一定条件下可以发生取代、加成、消去、氧化反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年北京五十六中九高三上学期期中考试化学试卷(解析版) 题型:选择题
下列叙述中,不正确的是
A.单质硅是重要的半导体材料
B.二氧化硅是制造光导纤维的材料
C.硅酸钠可以做木材防火剂
D.自然界里存在大量的单质硅和二氧化硅
查看答案和解析>>
科目:高中化学 来源:2016-2017学年北京五十六中九高三上学期期中考试化学试卷(解析版) 题型:选择题
下列物质中,属于弱电解质的是
A.CH3COOH B.H2SO4 C.NaOH D.Na2CO3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西桂林市高三上学期期中考化学试卷(解析版) 题型:选择题
某混合气体由两种气态烃组成,取2.24升该混合气体,完全燃烧得到4.48升二氧化碳和3.6克水(气体体积均在标准况下测定),则这种混合气体组成可能是( )
A. C3H4和CH4 B. C2H4和C3H4
C. C2H4和C2H6 D. C2H2和C3H6
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上阶段考二化学卷(解析版) 题型:实验题
I.某烧碱样品含有少量不与酸作用的杂质,为了测定其纯度,进行以下操作:
A.在250 mL的容量瓶中准确配制250 mL烧碱溶液
B.用碱式滴定管移取25 mL烧碱溶液于锥形瓶中并滴入2滴甲基橙指示剂
C.在天平上准确称取烧碱样 品m g,在烧杯中用蒸馏水溶解
品m g,在烧杯中用蒸馏水溶解
D.将浓度为c mol·L-1的标准硫酸装入酸式滴定管,调整液面记下开始读数V1
E.在锥形瓶下垫一张白纸,滴定至橙色为止,记下读数V2
就此实验完成下列填空:
(1)正确的操作步骤的顺序是(用编号字母填写):________________。
(2)下列操作中可能使所测NaOH的质量分数偏低的是__________。
a.滴定操作中,锥形瓶残留少量蒸馏水
b.B步操作中,装入烧碱溶液之前未用待测液润洗
c.D步操作中酸式滴定管在装入标准H2SO4溶液前未用标准液润洗
d.读取硫酸体积时,开始时仰视读数,结束时俯视读数
(3)该烧碱样品纯度的计算式为______________________。
II.以下是FeSO4·7H2O的实验窒制备流理图。
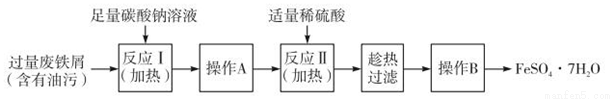
根据题意完成下列填空:
(1)反应1需要加热数分钟,其原因是 ;操作A为 。
(2)测定FeSO4·7H2O产品中Fe2+含量的常用方法是KMnO4溶液滴定法。已知称取3.0g FeSO4·7H2O产品,配制成溶液,用硫酸酸化的0.01moL·L-1 KMnO4溶液滴定,消耗KMnO4溶液的体积为200.00mL。KMnO 4溶液应盛装在 滴定管中,发生反应的离子方程式为 ,计算上述样品中FeSO4·7H2O的质量分数为 (保留两位有效数字)。[
4溶液应盛装在 滴定管中,发生反应的离子方程式为 ,计算上述样品中FeSO4·7H2O的质量分数为 (保留两位有效数字)。[
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com