
【题目】以丙烯为原料合成抗炎药物D和机体免疫增强制剂Ⅰ的合成路线如下(部分反应条件和产物己经略去):
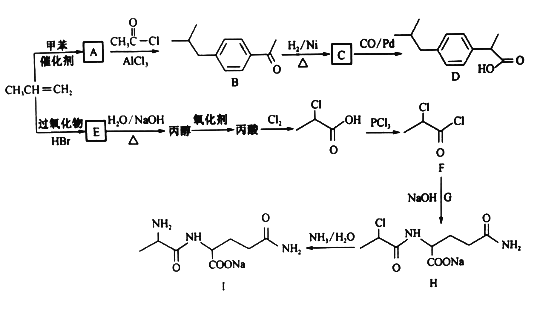
回答下列问题:
(1)由丙烯生成A的反应类型为________,由H生成I的反应类型为______________。
(2)E的结构简式为_____________,F中含氧官能团的名称为___________________。
(3)化合物G的化学式为C5H10O3N2,则其结构简式为___________________。
(4)A→B反应的化学方程式为 ________。
(5)A的同分异构体中属于苯的同系物的共有________种(不包含A),其中核磁共振氢谱有四组峰的
是________ (写一种结构简式)。
(6)已知: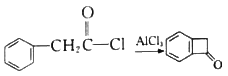 。结合上述流程中的信息,设计由制备
。结合上述流程中的信息,设计由制备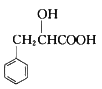 制备
制备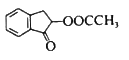 的合成路线:_______________________。
的合成路线:_______________________。
【答案】 加成反应 取代反应 ![]() 羰基(或其他合理答案)
羰基(或其他合理答案) 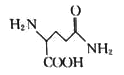
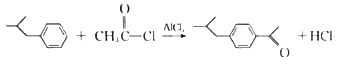 11
11 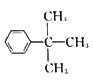

【解析】由丙烯与甲苯发生加成反应生成的A为![]() ,A再CH3COCl发生取代反应生成B为
,A再CH3COCl发生取代反应生成B为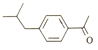 ,
, 再与H2发生加成生成的C为
再与H2发生加成生成的C为![]() ;丙烯在过氧化物催化作用下与HBr发生加成反应生成的E水解后得到丙醇,可知E为CH3CH2CH2Br;
;丙烯在过氧化物催化作用下与HBr发生加成反应生成的E水解后得到丙醇,可知E为CH3CH2CH2Br;
(1)由丙烯生成![]() 的反应类型为加成反应,由
的反应类型为加成反应,由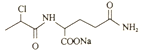 生成
生成 的反应为氯原子被氨基取代,属取代反应;
的反应为氯原子被氨基取代,属取代反应;
(2) 由分析可知E的结构简式为CH3CH2CH2Br,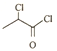 中含氧官能团的名称为羰基;
中含氧官能团的名称为羰基;
(3) 和化合物G在碱性条件下反应生成
和化合物G在碱性条件下反应生成 ,结合生成物的结构特点和G的化学式为C5H10O3N2,可知发生了取代反应,可知G的结构简式为
,结合生成物的结构特点和G的化学式为C5H10O3N2,可知发生了取代反应,可知G的结构简式为 ;
;
(4)![]() 和CH3COCl在催化剂AlCl3的作用下发生取代反应生成
和CH3COCl在催化剂AlCl3的作用下发生取代反应生成 的化学方程式为
的化学方程式为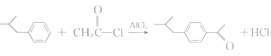 ;
;
(5) ![]() 的同分异构体中属于苯的同系物包括:苯环上有一个甲基和一个丙基或异丙基,结合邻、间、对位应该有6种;苯环上有2个乙基共有3种;苯环上只有一个取代基,丁基有4种,排除A,还有3种;则共有11种符合条件的同分异构体,其中核磁共振氢谱有四组峰的是
的同分异构体中属于苯的同系物包括:苯环上有一个甲基和一个丙基或异丙基,结合邻、间、对位应该有6种;苯环上有2个乙基共有3种;苯环上只有一个取代基,丁基有4种,排除A,还有3种;则共有11种符合条件的同分异构体,其中核磁共振氢谱有四组峰的是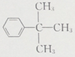 ;
;
(6根据提供的信息,由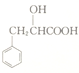 制备
制备![]() 的合成路线为
的合成路线为 。
。


科目:高中化学 来源: 题型:
【题目】硒(Se)是人体健康必需的一种微量元素。已知Se的原子结构示意图为: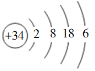 。下列说法不正确的是
。下列说法不正确的是
A. 该原子的质量数为34B. 该元素处于第四周期第ⅥA族
C. SeO2既有氧化性又有还原性D. 酸性:HBrO4 > H2SeO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝氢化钠(NaAlH4) 是有机合成的重要还原剂。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质) 为原料制备铝氢化钠的一种工艺流程如下:
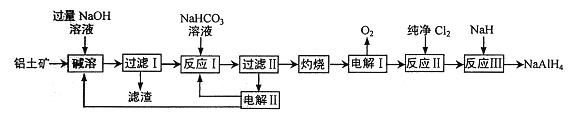
注: SiO2在“碱溶”时转化为铝硅酸钠(Na2Al2SixO8) 沉淀。
(1)铝硅酸钠(Na2Al2SixO8) 可以用氧化物的形式表示其组成,形式为________。
(2) “过滤I”中滤渣主要成分有________(写名称)。向“过滤I”所得滤液中加入NaHCO3溶液,反应的离子方程式为_______________、______________。
(3) “电解I”的另一产物在1000℃时可与N2反应制备AlN,在这种产物中添加少量NH4Cl固体并充分混合,有利于AlN 的制备,其主要原因是__________________。
(4)“电解II”是电解Na2CO3溶液,原理如图所示。
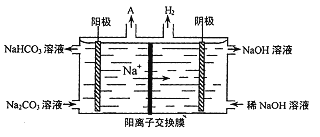
阳极的电极反应式为_________________。
(5)铝氢化钠遇水发生剧烈反应产生大量气泡,其反应的化学方程式为_____________,每产生1mol 气体转移电子数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应mA(s)+nB(g)![]() pC(g)△H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是( )
pC(g)△H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是( )
①m+n>p ②x点表示的正反应速率大于逆反应速率
③x点比y点时的反应速率慢 ④n>p
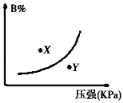
A. ①② B. ②④ C. ②③ D. ①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为原子序数依次增大的短周期元素,已知A、B、D三种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4。
(1)写出下列元素符号: B________,D________。
(2)A与D两元素可形成化合物,用电子式表示其化合物的形成过程:________。
(3)A在空气中燃烧生成原子个数比为1:1的化合物,写出其电子式为________。
(4)元素C的最高价氧化物与元素A的最高价氧化物的水化物反应的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:

(1)定性比较:图甲可通过观察___________,定性比较得出结论。有同学提出将CuSO4改为CuCl2更合理,其理由是_____________。
(2)定量比较:如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。实验中需要测量的数据是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钮扣电池的电极材料为Zn和Ag2O,电解质溶液为KOH,其电极反应为:Zn + 2OH--2e-=ZnO+ H2O 、Ag2O + H2O + 2e-=2Ag+ 2OH-,电池的负极是_____(填电极材料),正极发生的是_____反应(填反应类型),总反应式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】晶须是由高纯度单晶生长而成的微纳米级的短纤维,工业应用的晶须主要是在人工控制条件下合成。
碳酸镁晶须(MgCO3·nH2O,n = 1~5的整数)广泛应用于冶金、耐火材料及化工产品等领域。制取碳酸镁晶须的步骤如图:
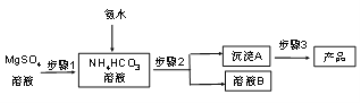
完成下列填空:
(1)步骤1必须将反应的温度控制在50℃,较好的加热方法是_______________________;氨水、硫酸镁、碳酸氢铵三者反应,除生成MgCO3·nH2O沉淀外,同时生成的产物还有______________________________________。
(2)步骤2是__________、洗涤,检验沉淀A已洗涤干净的方法是_____________________。
为测定碳酸镁晶须产品中n的值,某兴趣小组设计了如下装置,并进行了三次实验。(不考虑稀盐酸的挥发性)
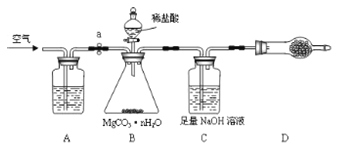
(3)装置A中盛放的溶液是_____________。装置D中盛放的固体是___________________,其作用是_________________________________。
(4)若三次实验测得每1.000g碳酸镁晶须产生的CO2平均值为a mol,则n值为__________________(用含a的代数式表达)。
(5)下列选项中,会造成实验结果偏大的是____________。 (选填序号)
①实验开始,未先通空气,即称量装置C; ②B中反应结束后,没有继续通空气;
③缺少装置A; ④缺少装置D;
⑤装置B中稀盐酸的滴加速率过快; ⑥装置C中的NaOH溶液浓度过大。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E为原子序数依次增大的前四周期元素。已知A和C同主族,B和D同主族。基态A原子核外有6个不同运动状态的电子,D原子次外层电子数等于其余各层电子数之和,基态E原子除最外层只有一个电子外。次外层各能级均为全充满状态。
试回答下列问题:
(1)A元素在形成化合物时,其所成化学键以共价键为主,其原因是____;基态C原子核外自旋方向相同的电子最多有_____个。
(2)元素B第一电离能小于同周期相邻元索的主要原因为_________
(3)写出两个与CB32-具有相同空间构型和键合形式的分子或离子_______。
(4)B与D能形成化合物F,將纯液态F冷却到一定温度下得到一种螺旋状单链结构的固体,如下降所示,则F的化学式为______,此固体中D原子的杂化类型是_______

(5)D与E能形成化合物G,其品胞结构及品胞参数如图所示:
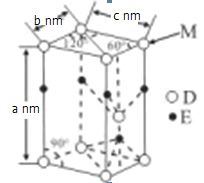
M处的D原子被______个晶胞共用,G的密度为______g/cm3(用含a、b、c、NA的代数式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com