
���� ��1��������Һ��������Ũ�ȼ���ʣ����������ʵ��������������ʵ�����ȥʣ���������ʵ�����Ϊ���ĵ��������ʵ�����
��2����������֪����AΪSO2��H2������壬��SO2�����ʵ���Ϊxmol��H2���ʵ���Ϊy mol���������������ʵ����������������ʵ����з��̼��㣻
��3�����ݵ���ת���غ㣬��֪��n��Zn��=n��SO2��+n��H2�����ٸ���m=nM���㣻
��4�����ZnԪ�ػ��ϼ۱仯����ת�Ƶ��ӣ�
��� �⣺����A�����ʵ��� n��A��=$\frac{22.4L}{22.4L/mol}$=1mol
��1����Ӧ����������H2SO4�����ʵ�����n��H2SO4��=0.1L��16.5 mol/L-1 L��0.1 mol/L=1.60 mol��
�𣺷�Ӧ���������ĵ�H2SO4�����ʵ�����1.60mol��
��2����������֪����AΪSO2��H2������壬��SO2�����ʵ���Ϊxmol��H2���ʵ���Ϊy mol����
Zn+2H2SO4��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$ZnSO4+SO2��+2H2O
2 mol 1mol
2x mol x mol
Zn+H2SO4��ϡ���TZnSO4+H2��
1 mol 1 mol
y mol ymol
���ԣ�$\left\{\begin{array}{l}{2x+y=1.6}\\{x+y=1}\end{array}\right.$
���x=0.6��y=0.4
��SO2��H2�����֮��=0.6mol��0.4mol=3��2��
��������SO2��H2�����֮��Ϊ3��2��
��3�����ݵ���ת���غ㣬��֪��n��Zn��=n��SO2��+n��H2��=1mol��������Zn������Ϊ1mol��65g/mol=65g��
�����ĵ�п��������65g��
��4�����ĵ�ZnΪ1mol����Ӧ��ת�Ƶ���Ϊ1mol��2=2mol��
�𣺷�Ӧ��ת�Ƶ���Ϊ2mol��
���� ���⿼�黯ѧ����ʽ���㣬ע��Ũ�����ϡ�������ʵIJ�ͬ�����غ�ĽǶȽ��н�𣬽Ϻõؿ���ѧ����������������


 ��˼ά������ҵ���ټ��ִ�ѧ������ϵ�д�
��˼ά������ҵ���ټ��ִ�ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����1molCO2��ͬʱ����2molH2O | B�� | n��H2O����n��H2��=1��1 | ||
| C�� | 2v����H2O��=v����CO2�� | D�� | �����������ѹǿ�������仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | n+8 | B�� | n+16 | C�� | n+18 | D�� | n+32 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | һ�������£���1 mol N2��3 mol H2��ϣ���ַ�Ӧ��ת�Ƶĵ�����Ϊ6NA | |
| B�� | 6.4 g��S2��S4��S8��ɵĻ���ﺬ��ԭ����Ϊ0.2 NA | |
| C�� | 0.1mol/LNH4Cl��Һ��Cl-������Ϊ0.1NA | |
| D�� | 2.24LNH3��CH4�Ļ�����壬����������Ϊ2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | X������һ������M��������Y������һ������N������ | |
| B�� | �ƻ���Ӧ���еĻ�ѧ�������յ�����С���γ��������л�ѧ�����ų������� | |
| C�� | X��Y��������һ������M��N�������� | |
| D�� | ��Ϊ�÷�ӦΪ���ȷ�Ӧ���ʷ�Ӧһ��Ҫ���Ȳ��ܽ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
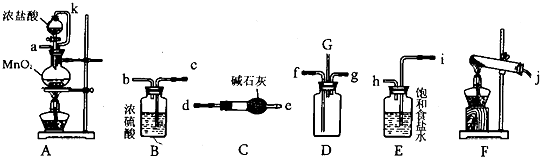
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ԭ�����Һ��c��K+��Ϊ2 mol•L-1 | |
| B�� | �����������й�ת��2 mol���� | |
| C�� | �����õ�����ϵ�м�1molCu2��OH��2CO3���壬��ʹ��Һ�ָ������ǰ��Ũ�� | |
| D�� | ������Һ��c��H+��Ϊ2 mol•L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
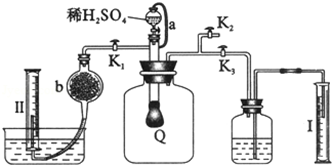
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com