
分析 计算碳酸钙的溶解度,可计算100g水中溶解的碳酸钙的质量,根据CaCO3的Ksp为2.5×10-9,可计算1L溶液中溶解碳酸钙的物质的量,进而计算100mL的溶质的质量,以此解答该题.
解答 解:CaCO3的Ksp为2.5×10-9,则c(CaCO3)=c(Ca2+)=$\sqrt{2.5×1{0}^{-9}}$mol/L=5×10-5mol/L,即1000mL可溶解5×10-5mol碳酸钙,m(CaCO3)=5×10-5mol×100g/mol=5×10-3g,则100g水溶解碳酸钙的质量为5×10-4g,即溶解度是5×10-4g,
故答案为:5×10-4.
点评 本题考查溶度积常数、溶解度的综合计算,为高频考点,侧重考查学生的分析、计算能力,题目难度中等,平时学习中要特别重视计算能力的培养.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
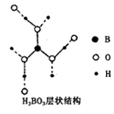 正硼酸(H3B03)是一种片层状结构的白色晶体,层内的H3B03分子之间通过氢 键相连(层状结构如图所示,图中“虚线”表示氢键).下列有关说法正确的是( )
正硼酸(H3B03)是一种片层状结构的白色晶体,层内的H3B03分子之间通过氢 键相连(层状结构如图所示,图中“虚线”表示氢键).下列有关说法正确的是( )| A. | 含1 mol H3BO3的晶体中有6 mol氢键 | |
| B. | 分子中硼原子、氧原子最外层均为8e-的稳定结构 | |
| C. | 正硼酸晶体属于原子晶体 | |
| D. | H3BO3分子的稳定性与氢键无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
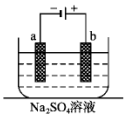 如图为直流电源电解稀Na2SO4水溶液的装置.通电后在石墨电极a和b附近分别滴加一滴石蕊溶液.下列实验现象中错误的是( )
如图为直流电源电解稀Na2SO4水溶液的装置.通电后在石墨电极a和b附近分别滴加一滴石蕊溶液.下列实验现象中错误的是( )| A. | 电子的流向:负极→a电极→b电极→正极 | |
| B. | a电极附近呈蓝色,b电极附近呈红色 | |
| C. | 逸出气体的体积,a电极的大于b电极的 | |
| D. | Na+向a极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若c(Fe2+)与c(Cu2+)相等时,该反应达到平衡状态 | |
| B. | 向平衡体系中加入少量硫酸铜晶体后,FeS的KSP减小 | |
| C. | 其他条件不变,增大FeS的物质的量,该反应的正反应速率增大 | |
| D. | 该反应的化学平衡常数K=$\frac{{K}_{sp}(FeS)}{{K}_{sp}(CuS)}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溶液中Ca2+数目减少 | B. | 溶液pH值增大 | ||
| C. | 溶液中c(Ca2+)增大 | D. | 溶液pH值不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 元素 性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 平衡不移动 | |
| B. | 平衡向正反应方向移动,Cl2的转化率增大 | |
| C. | 平衡移动,且HClO浓度减小 | |
| D. | 平衡移动,且HClO浓度增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com