
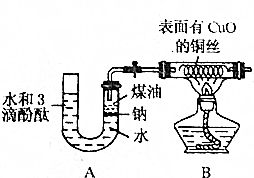
 某课外活动小组为了检验钠与水反应的产物,设计如图装置(夹持装置省略).首先在U形管内加入少量煤油和几粒钠块,再从U形管高端加入水(含有酚酞),赶出空气,一会儿加热铜丝.
某课外活动小组为了检验钠与水反应的产物,设计如图装置(夹持装置省略).首先在U形管内加入少量煤油和几粒钠块,再从U形管高端加入水(含有酚酞),赶出空气,一会儿加热铜丝.分析 首先在U形管内加入少量煤油和几粒钠块,再从U形管高端加入水(含有酚酞),赶出空气,一会儿加热铜丝.由于该装置为密闭条件且增加了煤油,反应现象更加便于观察,生成的物质便于检验,钠与水的反应体现钠的多种性质,如颜色、状态及熔点低和密度小的特点,钠位于水和煤油界面上,与水发生反应得到氢氧化钠溶液,
(1)钠熔点低,反应过程中熔成金属小球,密度小于水,大于煤油,反应时在水和煤油界面处上下跳动;
(2)钠和水反应生成氢氧化钠溶液显碱性,酚酞变红色;
(3)生成的氢气通过表面有氧化铜的铜丝,氢气会和氧化铜反应生成铜和水;
(4)依据化学方程式:2Na+2H2O=a2NaOH+H2↑,反应中的定量关系计算,得到溶液溶质为氢氧化钠,溶液质量等于钠和水质量总和减去生成的氢气质量,溶质质量分数$\frac{溶质质量}{溶液总质量}$×100%.
解答 解:由于该装置为密闭条件且增加了煤油,反应现象更加便于观察,生成的物质便于检验,钠与水的反应体现钠的多种性质,如颜色、状态及熔点低和密度小的特点,钠密度小于水,大于煤油,反应时位于水和煤油界面上,作上下跳动且逐渐变小,
(1)钠熔点低,反应过程中熔成金属小球,密度大于水,小于煤油,反应时在水和煤油界面处上下跳动,反应现象;熔成银白色小球,在水和煤油的界面上作上下跳动且逐渐变小,
故答案为:熔成银白色小球,在水和煤油的界面上作上下跳动且逐渐变小;
(2)钠和水反应生成氢氧化钠溶液显碱性,与水发生反应的化学方程式:2Na+2H2O=a2NaOH+H2↑,生成的氢氧化钠是碱遇到酚酞变红色,U形管中溶液的颜色从上到下逐渐由无色变为红色,
故答案为:从上到下逐渐由无色变为红色,NaOH;
(3)生成的氢气通过表面有氧化铜的铜丝,氢气会和氧化铜反应生成铜和水,生成的H2发生反应:H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O,反应现象由黑色变红色,说明钠和水反应生成氢气,
故答案为:由黑色变红色,H2;
(4)依据化学方程式:钠与水完全反应得NaOH溶液:
2Na+2H2O=2NaOH+H2↑
2×23 2×40 2
ag $\frac{40a}{23}$g $\frac{a}{23}$g
则w(NaOH)=$\frac{\frac{40a}{23}g}{ag+bg-\frac{a}{23}g}$×100%=$\frac{40a}{22a+23b}$×100%,
故答案为:$\frac{40a}{22a+23b}$×100%.
点评 本题装置是钠与水反应实验的改进装置,主要是钠的物理性质和化学性质分析,化学方程式计算,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 22.4 L N2和NH3混合气体中原子间共有3NA个共用电子对 | |
| B. | 3.0 g甲醛HCHO和乙酸混合物中共含碳原子数为0.1NA | |
| C. | 25℃时pH=1的醋酸溶液中含有H+的数目为0.1NA | |
| D. | 标准状况下,2.24 L CH2Cl2含有的分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
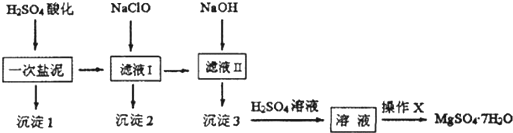
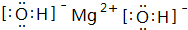 (写电子式).
(写电子式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L NH4HCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3- )>c(OH-) | |
| B. | 20ml 0.1mol/L CH3COONa溶液与10ml 0.1mol/LHCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+ )>c(OH-) | |
| D. | 0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用稀盐酸清洗装石灰水的试剂瓶:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | 用稀盐酸清洗试管中的二氧化锰:MnO2+4H++2Cl-═Mn2++Cl2↑+2H2O | |
| C. | 用稀硝酸溶解试管中的银镜:3Ag+NO3-+4H+═3Ag++NO↑+2H2O | |
| D. | 用稀硫酸清洗试管中的氧化铜:CuO+2H+═Cu2++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ①②③④ | D. | ①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com