
| 阳离子 | K+、Na+、Al3+、Cu2+ |
| 阴离子 | OH-、HCO3-、NO3-、SO42- |
分析 ①将它们溶于水后,D为蓝色溶液,其它均为无色溶液,则D为可溶性铜盐;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀完全溶解,C中含有铝离子、E为强碱;
③进行焰色反应,B、C为紫色(透过蓝色钴玻璃),A、E为黄色,则BC含有钾元素、AE含有钠元素,所以E为NaOH;
④在各溶液中加入氯化钡溶液,再加过量稀盐酸,A中放出无色气体,则A中含有碳酸氢根离子,为NaHCO3;
C、D中产生白色沉淀,B中无明显现象,D为CuSO4,则C含有K、Al元素和硫酸根离子,则C为KAl(SO4)2;
⑤将B、D两溶液混合,未见沉淀或气体生成,且B含有钾元素,所以B为KNO3;
据此分析解答.
解答 解:①将它们溶于水后,D为蓝色溶液,其它均为无色溶液,则D为可溶性铜盐;
②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀完全溶解,C中含有铝离子、E为强碱;
③进行焰色反应,B、C为紫色(透过蓝色钴玻璃),A、E为黄色,则BC含有钾元素、AE含有钠元素,所以E为NaOH;
④在各溶液中加入氯化钡溶液,再加过量稀盐酸,A中放出无色气体,则A中含有碳酸氢根离子,为NaHCO3;
C、D中产生白色沉淀,B中无明显现象,D为CuSO4,则C含有K、Al元素和硫酸根离子,则C为KAl(SO4)2;
⑤将B、D两溶液混合,未见沉淀或气体生成,且B含有钾元素,所以B为KNO3;
通过以上分析知,A、B、C分别是NaHCO3、KAl(SO4)2
故答案为:NaHCO3;KNO3;KAl(SO4)2.
点评 本题考查物质检验鉴别实验方案设计,为高频考点,明确物质性质及物质之间反应是解本题关键,利用物质性质的特殊性进行分析推断,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | H | B. | F | C. | Na | D. | Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
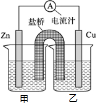 (1)已知下热化学方程式:
(1)已知下热化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 白色固体中既有KI,又有BaCl2 | B. | 白色固体中既有NaBr,又有BaCl2 | ||
| C. | 白色固体中可能有KI | D. | 白色固体中可能没有NaBr |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
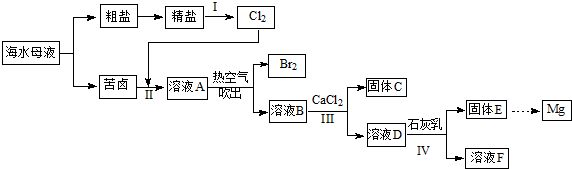
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A.打磨磁石制指南针 | B.烧结粘土制陶瓷 | C.湿法炼铜 | D.铁的冶炼 |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com