

| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
分析 废钒催化剂粉碎、水浸,将溶解性物质溶于水,然后过滤得到滤渣和滤液,根据溶解性表知,滤液中含有VOSO4,滤渣中含有V2O5等不溶性杂质,向滤渣中加入亚硫酸钠和稀硫酸,亚硫酸钠具有还原性,能将V2O5还原为VOSO4,然后过滤得到滤渣和滤液,将两部分滤液混合并加入氯酸钾,氯酸钾具有氧化性,能将VOSO4氧化为(VO2)2SO4,调节溶液pH为8且采用离子交换方法得到VO3-,向溶液中加入氯化铵,得到难溶性的NH4VO3,焙烧NH4VO3得到V2O5,
(1)工业由V2O5冶炼金属钒常用铝热剂法,铝和五氧化二钒在高温下发生置换反应生成V,根据反应物、生成物及反应条件书写方程式;
(2)VOSO4为可溶性物质;
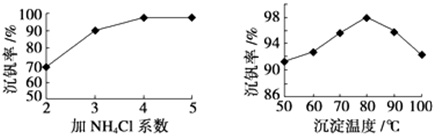
(3)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,铵根离子和VO3-反应生成难溶性的NH4VO3,根据图知,在80℃、氯化铵系数为4时沉降率最大;
(4)该反应中V元素化合价由+5价变为+4价、C元素化合价由+3价变为+4价,转移电子数为2,再结合原子守恒、电荷守恒配平方程式;
(5)全矾液流电池的电解质溶液为VOSO4溶液,根据电池的工作原理,电池充电时阳极上VO2+失电子发生氧化反应.
解答 解:废钒催化剂粉碎、水浸,将溶解性物质溶于水,然后过滤得到滤渣和滤液,根据溶解性表知,滤液中含有VOSO4,滤渣中含有V2O5等不溶性杂质,向滤渣中加入亚硫酸钠和稀硫酸,亚硫酸钠具有还原性,能将V2O5还原为VOSO4,然后过滤得到滤渣和滤液,将两部分滤液混合并加入氯酸钾,氯酸钾具有氧化性,能将VOSO4氧化为(VO2)2SO4,调节溶液pH为8且采用离子交换方法得到VO3-,向溶液中加入氯化铵,得到难溶性的NH4VO3,焙烧NH4VO3得到V2O5,
(1)工业由V2O5冶炼金属钒常用铝热剂法,铝和五氧化二钒在高温下发生置换反应生成V,根据反应物、生成物及反应条件知,该反应方程式为3V2O5+10Al$\frac{\underline{\;高温\;}}{\;}$5Al2O3+6V,故答案为:3V2O5+10Al$\frac{\underline{\;高温\;}}{\;}$5Al2O3+6V;
(2)VOSO4为可溶性物质,所以溶液中的溶质为VOSO4,故答案为:VOSO4;
(3)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,铵根离子和VO3-反应生成难溶性的NH4VO3,离子方程式为NH4++VO3-=NH4VO3↓,根据图知,在80℃、氯化铵系数为4时沉降率最大,故答案为:NH4++VO3-=NH4VO3↓;4;80℃;
(4)该反应中V元素化合价由+5价变为+4价、C元素化合价由+3价变为+4价,转移电子数为2,再结合原子守恒、电荷守恒配平方程式为2VO2++H2C2O4+2H+=2VO2++2CO2↑+2H2O,故答案为:2VO2++H2C2O4+2H+=2VO2++2CO2↑+2H2O;
(5)全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为VO2++V2++2H+$?_{充电}^{放电}$VO2++H2O+V3+,电池充电时阳极上VO2+失电子发生氧化反应,电极反应式为VO2++H2O-e-=VO2++2H+,故答案为:VO2++H2O-e-=VO2++2H+.
点评 本题考查物质的分离和提纯,为高频考点,侧重考查氧化还原反应、离子反应方程式的书写、原电池和电解池原理等知识点,明确反应原理是解本题关键,知道流程图中发生的反应及实验基本操作,难点是电极反应式的书写,题目难度较大.


 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:选择题
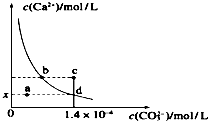 室温时,CaCO3在水中的沉淀溶解平衡曲线如图所示.已知CaCO3的溶度积(室温)为2.8×10-9,下列说法中不正确的是( )
室温时,CaCO3在水中的沉淀溶解平衡曲线如图所示.已知CaCO3的溶度积(室温)为2.8×10-9,下列说法中不正确的是( )| A. | x的数值为2×10-5 | B. | c点时有CaCO3生成 | ||
| C. | 加入蒸馏水可使溶液由d点变成a点 | D. | b点与d点对应的溶度积相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何状态下,1molCO2和18克水所含的分子数和原子数都相等 | |
| B. | 22.4L的任何气体的物质的量为1mol | |
| C. | 非标准状况下,1mol任何气体的体积必定不是22.4L | |
| D. | 标准状况下,1molSO3的体积是22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 分子式 | 外观 | 热分解温度 | 熔点 | 溶解性 |
| CO(NH2)2•H2O2 | 白色晶体 | 45℃ | 75-85℃ | 易溶于水、有机溶剂 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,H2+Cl2=2HCl在光照和点燃条件的△H不同 | |
| B. | 铅蓄电池在放电过程中,负极质量减小,正极质量增加 | |
| C. | 天然气、沼气和水煤气分别属于化石能源、可再生能源和一级能源 | |
| D. | 元素原子的核外电子排布呈周期性变化是元素性质呈现周期性变化的根本原因 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1000Vρ}{22400+36.5V}$ mol/L | B. | $\frac{Vρ}{22400}$ mol/L | ||
| C. | $\frac{Vρ}{22400+36.5}$ mol/L | D. | $\frac{V}{22.4}$ mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 性质 | 应用 |
| A | 油脂在一定条件下能发生水解反应 | 油脂在碱性条件下水解制肥皂 |
| B | 硫酸铵等盐类 能使蛋白质变性 | 可用硫酸铵作杀菌消毒剂 |
| C | 糖类都能发生水解反应 | 可用淀粉、纤维素水解制葡萄糖 |
| D | 明矾溶于水可发生水解反应 | 明矾可用于自来水的净化、杀菌消毒 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 混合气体的平均分子质量不变 | B. | 密闭容器中总压强不变 | ||
| C. | 混合气体的密度不变 | D. | 密闭容器中CO2的体积分数不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com