
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下:
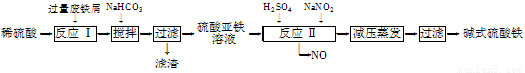
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
(1)加入过量废铁屑的目的是????????????????????????? 。
(2)加入少量NaHCO3的目的是调节pH,使溶液中的________(选填“Fe3+”、“Fe2+”或“Al3+”)沉淀。该工艺流程中“搅拌”的作用是???????????????????????? 。
(3)反应Ⅱ的离子方程式为????????????????????????? 。在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作????????? 。若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为??????????????? 。
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子。该水解反应的离子方程式为????????????????????????????????????????????????? 。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为??????? 。
A.氯水??? ? B.KSCN溶液??? ? C.NaOH溶液??? ? D.酸性KMnO4溶液
(6)将11.9 g Mg、Al、Fe组成的合金溶于足量的NaOH溶液中,合金质量减少了2.7 g。另取等质量的合金溶于过量稀硝酸中,生成了6.72 L(标准状况下)NO,向反应后的溶液中加入适量NaOH溶液恰好使Mg2+、Al3+、Fe3+完全转化为沉淀,则沉淀质量为??????? 。
A.22.1 g?????? B.27.2 g???????? C.30 g?????????? D.无法确定
(1)使硫酸充分反应掉、提高硫酸利用率或使Fe3+尽可能转化为Fe2+(2分,答对一点即可得2分,其它合理答案也可)
(2)Al3+(1分)
加快反应速率(或使反应物充分接触)(1分,意思相近均给分)
(3) Fe2+ + NO2- + 2H+ = Fe3+ + NO↑ + H2O? (2分,漏反应条件或“↑”扣1分;未配平扣1分);
氧化剂(1分);
2 mol(1分)
(4)2Fe(OH)2++2H2O Fe2(OH)42-+2H+(2分,写成等号扣1分;未配平扣1分)??
Fe2(OH)42-+2H+(2分,写成等号扣1分;未配平扣1分)??
(5)D(2分,多选0分)
(6)B(3分)
【解析】
试题分析:(1)加入过量的铁可以与硫酸和Fe3+反应,为后面调节pH除去多余的硫酸并将Fe3+尽可能转化为Fe2+,(2)根据流程图得到的是硫酸亚铁溶液,所以先沉淀的是Al3+ ,搅拌可以加快反应速率;(3)Fe2+ 和 NO2- 在酸性条件下发生氧化还原反应:Fe2+ + NO2- + 2H+ = Fe3+ + NO↑ + H2O,氧气和亚硝酸钠都做氧化剂,1 mol氧气转移电子4mol ,1 mol亚硝酸钠转移电子1mol,根据电子守恒可得;(4)[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子,根据电荷守恒和质量守恒可写出反应的离子方程式为2[Fe(OH)]2++2H2O=[Fe2(OH)4]2++2H+,; (5)酸性KMnO4溶液氧化亚铁离子高锰酸钾溶液褪色;(6)加入氢氧化钠后,金属质量减少的就是铝的质量。根据电子守恒可分别计算出铁和镁的质量,最后计算出沉淀质量。
考点:考查工艺流程、氧化还原反应离子方程式的书写及有关计算。


科目:高中化学 来源: 题型:阅读理解

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
 [Fe2(OH)4]2++2H+
[Fe2(OH)4]2++2H+ [Fe2(OH)4]2++2H+
[Fe2(OH)4]2++2H+
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
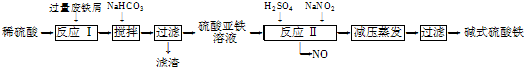
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
2+ 4 |
- 3 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省高三上学期期中考试化学试卷(解析版) 题型:填空题
铁及其化合物在日常生活、生产中应用广泛.研究铁及其化合物的应用意义重大.
I.水体的净化和污水的处理与铁及其化合物密切相关.
(1)自来水厂常用高铁酸钠(Na2FeO4)改善水质.简述高铁酸钠用于杀菌消毒同时又起到净水作用的原理 .
(2)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
|
沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
|
开始沉淀 |
2.3 |
7.5 |
3.4 |
|
完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
①写出反应I中主要发生的氧化还原反应的离子方程式 .
②加入少量NaHCO3的目的是调节溶液pH,应控制pH的范围为 .
③在实际生产中,反应II常同时通入O2以减少NaNO2的用量,若通入5.6L O2(标准状况),则相当于节约NaNO2的质量为 g.
④碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子.该水解反应的离子方程式为 .
II铁的化合物也是制备高能锂电池的重要原料.已知磷酸亚铁锂电池总反应为:FePO4+Li LiFePO4,电池中的固体电解质可传导Li+.试写出该电池充电时的阳极反应式
.
LiFePO4,电池中的固体电解质可传导Li+.试写出该电池充电时的阳极反应式
.
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省苏南四校高三12月月考试化学试卷(解析版) 题型:填空题
(12分)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
|
沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
|
开始沉淀 |
2.3 |
7.5 |
3.4 |
|
完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
(1)工业上常用一定浓度的纯碱溶液清洗铁屑,目的是 。
(2)加入少量NaHCO3的目的是调节溶液的pH至 a,a的范围是 。
(3)已知室温下,Al(OH)3的Ksp=1.3×10-33,当pH=5时,溶液中c(Al3+)=
(4)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为 ;O2参与反应的离子方程式为
(5)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子。该水解反应的离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com