
A、B、C是在中学化学中常见的3种化合物,它们各由两种元素组成,甲、乙是两种单质,这些化合物和单质之间存在如下的关系:
单质甲 ![]() 化合物A
化合物A
![]() 化合物B
化合物B ![]() 化合物B
化合物B
化合物A和化合物C 单质乙和化合物C
据此判断:
(1)在A、B、C这3种化合物中,必定含有乙元素的是 (用A、B、C字母填写)
(2)单质乙必定是 (填“金属”或“非金属”),其理由是 。
(3)单质乙的分子式可能是 ,则化合物B的分子式是
(1)A、B
(2)非金属,因为A+B→乙+ C,且乙为单质,可知乙元素在A、B中分别呈正、负价,所以乙是非金属。
(3)S、H2S(或N2、NH3)
本题初看起来,题设条件及框图并未给出明的线索,关键在于恰当动用逻辑推理。对于设问(1)化合物A是由甲、乙两种单质化合而成,则化合物A中一定含乙元素;再看左边纵行,单质甲与化合物B反应可生成A(舍乙元素)和C两种化合物,单质甲只含甲元素,则A中的乙元素只能来自化合物B,至于化合物C由题设条件无法判断。因此必定含乙元素的应该是A、B两种化合物。
至于设问(2),则需由框图的右侧纵行推理由化合物A与B(都舍乙元素)反应生成单质乙和化合物C,在单质乙中乙元素的化合价为零价,因此在A、B两种化合物中的乙元素必定分别是正、负两种化合价,因此乙元素必定是非金属元素。这是本题的关键性突破,也是难点。
最后看设问(3),在中学涉及的主要非金属氢、氧、碳、氮、硫、磷、氯中,在其二元化合物中分别呈正、负两种价态以硫、氮为常见。
本题考查了对图表的观察能力以及分析、推理、正向、逆向思维、抽象思维等多种思维能力,也考查了非金属元素的单质及化合物性质的综合认识水平,将化合价的基本概念与具体反应判断相结合,从而从高层次上考查了将化学知识按内在的联系抽象归纳,逻辑地统摄成规律的思维能力。


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:2010年安徽省高三教学质量检测试卷(三)理科综合化学 题型:填空题
(19分)已知A、B、C、D、E、F、C、H八种元素位于元素周期表前四个周期。A、B、C是三种非金属元素,A与B的原子的核外电子数之和与C原子的核外电子数相等且A、B、C能形成离子化合物。B与H位于同一主族,D的单质是中学化学常见的两性金属,E的单质是日常生活中用途最广泛的金属且其价电子数是G的两倍,F原子的最外电子层的p电子数是s电子数的两倍,D、H、F位于同一周期且原子序数依次增大,A、C、E、G、H的基态原子中未成对电子数均与其周期序数相同。请用化学用语回答以下问题:
(1)A、B、C形成的此化合物中存在的化学键的类型有 。E单质在常温下遇到A、B、C形成的另一化合物的浓溶液发生钝化现象,过量的E单质在此化合物的稀溶液中发生反应的离子方程式为 ,E的基态电子排布式为 ,E3+与E2+的稳定性大小为 。
(2)B、C、D、H四种元素的第一电离能由大到小的顺序为 ,电负性由小到大的顺序为 。
(3)A、C、G可形成一种相对分子质量为46的一元羧酸分子,其分子中存在的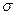 键和
键和 键的数目之比为 ;F、G对应的氢化物中键能大小为F—H键 G—H键。
键的数目之比为 ;F、G对应的氢化物中键能大小为F—H键 G—H键。
(4)等浓度、等体积的盐酸和氢氧化铀溶液分别与足量的D的单质反应放出的气体在常温常压下的体积比为 ,将所得溶液混合刚含有D元素的两种物质间发生反应的离子方程式为 。
(5)由A、C、F可形成两种酸类化合物,用离了方程式说明它们的酸性强弱 。由A、C、F与钠四种元素按原子个数比为l:3:1:1组成一种化合物,其水溶液硅酸性,则该溶液中各种离子的浓度由大到小的顺序为 ,向该溶液中滴入少量的氢氧化钡济液时发生反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年山东省济南市高三3月模拟考试理综化学试卷(解析版) 题型:填空题
A、B、C是中学化学中常见的三种元素(A、B、C代表元素符号)。A位于元素周期表中第4周期,其基态原子最外层电子数为2且内层轨道全部排满电子。短周期元素B的一种常见单质为淡黄色粉末。元素C的原子最外层电子数是其内层电子数的3倍。
(1)在第3周期中,第一电离能大于B的元素有??? 种;
A与B形成晶体的晶胞如图所示,该晶胞实际拥有Bn-的数目为???????

(2)B的氢化物(H2B)分子的空间构型为 ????????? ;在乙醇中的溶解度:s(H2C)>s(H2B),其原因是???????? 。
(3)B与C可形成BC42-
①BC42-中,B原子轨道的杂化类型是??? 。
②人们将价电子数和原子数分别相同的不同分子、离子或原子团称为等电子体。与BC42-互为等电子体的分子的化学式为? ??? ? (写出一种即可)。
(4)A的氯化物与氨水反应可形成配合物[A(NH3)4]Cl2,l mol该配合物中含有 键的物质的量为??? mol。
键的物质的量为??? mol。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
已知A、B、C、D、E、F、C、H八种元素位于元素周期表前四个周期。A、B、C是三种非金属元素,A与B的原子的核外电子数之和与C原子的核外电子数相等且A、B、C能形成离子化合物。B与H位于同一主族,D的单质是中学化学常见的两性金属,E的单质是日常生活中用途最广泛的金属且其价电子数是G的两倍,F原子的最外电子层的p电子数是s电子数的两倍,D、H、F位于同一周期且原子序数依次增大,A、C、E、G、H的基态原子中未成对电子数均与其周期序数相同。请用化学用语回答以下问题:
(1)A、B、C形成的此化合物中存在的化学键的类型有 。E单质在常温下遇到A、B、C形成的另一化合物的浓溶液发生钝化现象,过量的E单质在此化合物的稀溶液中发生反应的离子方程式为 ,E的基态电子排布式为 ,E3+与E2+的稳定性大小为 。
(2)B、C、D、H四种元素的第一电离能由大到小的顺序为 ,电负性由小到大的顺序为 。
(3)A、C、G可形成一种相对分子质量为46的一元羧酸分子,其分子中存在的![]() 键和
键和![]() 键的数目之比为 ;F、G对应的氢化物中键能大小为F—H键 G—H键。
键的数目之比为 ;F、G对应的氢化物中键能大小为F—H键 G—H键。
(4)等浓度、等体积的盐酸和氢氧化铀溶液分别与足量的D的单质反应放出的气体在常温常压下的体积比为 ,将所得溶液混合刚含有D元素的两种物质间发生反应的离子方程式为 。
(5)由A、C、F可形成两种酸类化合物,用离了方程式说明它们的酸性强弱 。由A、C、F与钠四种元素按原子个数比为l:3:1:1组成一种化合物,其水溶液硅酸性,则该溶液中各种离子的浓度由大到小的顺序为 ,向该溶液中滴入少量的氢氧化钡济液时发生反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2010年安徽省高考化学质检试卷(三)(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com