
| 金属离子 | Cu3+ | Ni3+ | Fe3+ | Al3+ | Cr3+ |
| 浓度(mg/L) | 7000 | 7000 | 2500 | 4200 | 3500 |
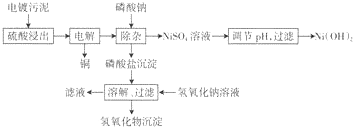
分析 电镀污泥加入硫酸浸出,通过电解得到铜,电解液中加入磷酸钠得到磷酸盐沉淀,加入氢氧化钠溶液溶解过滤得到氢氧化物沉淀,滤液主要是硫酸镍溶液,通过调节溶液PH使镍沉淀,过滤得到氢氧化镍,
(1)为提高浸出速率可以升温、搅拌、增大硫酸浓度等措施;
(2)镀污泥用硫酸浸出后得到的浸出液中各金属离子浓度可知,形成磷酸盐沉淀应为亚铁离子、铝离子和铬离子;
(3)依据浸出液中各金属离子浓度计算Ni离子物质的量浓度,结合溶度积常数计算溶液中P043-浓度;
(4)循环使用的物质是指参加反应过程最后又生成的物质,铝离子结合氢氧根离子生成的氢氧化铝沉淀是两性氢氧化物能溶于氢氧化钠溶液生成偏铝酸钠溶液;
(5)放电时,该装置是原电池,Cd为负极,电极反应式为Cd-2e-+2OH-=Cd(OH)2,正极反应式为NiOOH+H2O+e-═Ni(OH)2+OH-;
(6)在废水中加入过量的FeS04,在酸性条件下Cr2072-被还原为Cr3+,同时生成Fe3+;再加入过量的强碱生成铁铬氧体(CrxFe3-xO4)沉淀.写出加入过量强碱生成铁铬氧体( CrxFe3-xO4)沉淀,依据原子守恒和电荷守恒书写离子方程式;
解答 解:(1)硫酸浸出过程中,为提高浸出速率,可以采取的措施有加热、增大硫酸浓度、搅拌等,
故答案为:加热、增大硫酸浓度、搅拌;
(2)在电解回收铜的过程中,为提高下一步的除杂效果,需控制电解电压稍大一些使Fe2+氧化,则磷酸盐沉淀中含有的物质为,镀污泥用硫酸浸出后得到的浸出液中各金属离子浓度可知,形成磷酸盐沉淀应为亚铁离子、铝离子和铬离子,形成的沉淀为:FePO4、CrPO4、AlPO4,
故答案为:FePO4、CrPO4、AlPO4;
(3)浸出液中各金属离子浓度可知Ni2+浓度7000mg/L=7g/L,c(Ni)=$\frac{\frac{7g}{59g/mol}}{1L}$=$\frac{7}{59}$mol/L,若使Ni2+在除杂过程不损失,则溶液中P043-浓度不能超过Ksp[Ni3(P04)2]=c3(Ni2+)×c2(P043-)=5×l0-31,c(P043-)=$\sqrt{\frac{5×1{0}^{-31}}{(\frac{7}{59})^{3}}}$mol/L,
故答案为:$\sqrt{\frac{5×1{0}^{-31}}{(\frac{7}{59})^{3}}}$;
(4)滤液中循环使用的物质是指参加反应过程最后又生成的物质,分析流程可知磷酸钠参与反应过程最后又生成可以循环使用,当NaOH溶液浓度过大时,部分铝元素和铬元素会在滤液中出现,铝离子结合氢氧根离子生成的氢氧化铝沉淀是两性氢氧化物能溶于氢氧化钠溶液生成偏铝酸钠溶液,滤液中出现铝元素的原因是氢氧化铝溶于氢氧化钠溶液,反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Na3PO4,Al(OH)3+OH-=AlO2-+2H2O;
(5)放电时,正极发生还原反应,NiOOH被还原生成Ni(OH)2,电极方程式为NiOOH+H2O+e-═Ni(OH)2+OH-,
故答案为:NiOOH+H2O+e-=Ni(OH)2+OH-;
(6)在废水中加入过量的FeS04,在酸性条件下Cr2072-被还原为Cr3+,同时生成Fe3+;再加入过量的强碱生成铁铬氧体(CrxFe3-xO4)沉淀,加入过量强碱生成铁铬氧体( CrxFe3-xO4)沉淀的离子方程式为:xCr3++Fe2++(2-x) Fe3++8OH-=CrxFe3-xO4↓+4H2O
故答案为:xCr3++Fe2++(2-x) Fe3++8OH-=CrxFe3-xO4↓+4H2O;
点评 本题考查了物质分离提纯的过程分析判断,离子性质、离子反应、溶度积常数的计算,注意化学反应原理和化学方程式书写的理解应用,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径:C>D>A>B | B. | 原子序数:b>a>c>d | ||
| C. | 离子半径:Cn+>D(n+)->An+>B(n+)+ | D. | 单质还原性:A>B>C>D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
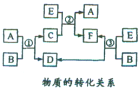 A、B、C、D、E、F六种物质在一定条件下有如图所示的转化关系,所有反应物和生成物均已给出.
A、B、C、D、E、F六种物质在一定条件下有如图所示的转化关系,所有反应物和生成物均已给出.| E的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(F的阴离子)/mol | 1.25 | 1.5 | 2 |
| n(C中的阴离子)/mol | 1.5 | 1.4 | y |
| n(B中的阴离子)/mol | x | 0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | N2(g)+3H2(g)?2NH3(g);△H=-Q1kJ/mol(Q1>0) | |
| B. | 2SO3(g)?2SO2(g)+O2(g);△H=+Q2 kJ/mol(Q2>0) | |
| C. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g);△H=-808.7 kJ/mol | |
| D. | 2CO(g)?C(s)+CO2(g);△H=-171.4kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 牛肉 | B. | 辣椒 | C. | 鸡蛋. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3,H2,CH4 | B. | PCl5,CO2,H2SO4 | C. | SO2,SiO2,P2O5 | D. | CCl4,Na2S,H2O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com