
| A. | 此氨水的pH为11.48 | |
| B. | Q溶液中:c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-)>c(H+) | |
| C. | Q溶液中:2c(Cl-)=c(NH3•H2O)+c(NH4+) | |
| D. | 滴加过程中,溶液中可能会存在:c(NH4+)=c(Cl-) |
分析 A.0.2mol/L的氨水电离出的铵根离子的浓度大约等于氢氧根离子的浓度,结合NH3•H2O的电离平衡常数计算;
B.0.2mol/L的氨水中滴加等体积的0.1mol/L的盐酸,混合溶液中溶质为等浓度的NH4Cl和NH3•H2O,NH3•H2O的电离程度大于铵根离子的水解程度,溶液显碱性;
C.根据物料守恒分析;
D.根据电荷守恒分析.
解答 解:A.0.2mol/L的氨水电离出的铵根离子的浓度大约等于氢氧根离子的浓度,c(OH-)=$\sqrt{1.8×1{0}^{-5}×0.2}$=所以c(OH-)=1.9×10-3mol/L,则c(H+)=5.3×10-12mol/L,故A错误;
B.0.2mol/L的氨水中滴加等体积的0.1mol/L的盐酸,混合溶液中溶质为等浓度的NH4Cl和NH3•H2O,NH3•H2O的电离程度大于铵根离子的水解程度,溶液显碱性,则c(OH-)>c(H+),NH3•H2O小部分电离,则c(NH3•H2O)>c(OH-),所以溶液中:c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-)>c(H+),故B正确;
C.溶液中溶质为等浓度的NH4Cl和NH3•H2O,由物料守恒可知,2c(Cl-)=c(NH3•H2O)+c(NH4+),故C正确;
D.向0.2mol/L的氨水中滴加等体积的0.1mol/L的盐酸,氨水过量,溶液显碱性,所以滴加过程中,c(OH-)>c(H+),由电荷守恒c(NH4+)+c(H+)=c(Cl-)+c(OH-)可知,c(NH4+)>c(Cl-),所以滴加过程中,溶液中不可能会存在:c(NH4+)=c(Cl-),故D错误.
故选AD.
点评 本题考查有关混合物反应pH的计算、离子浓度大小比较、盐的水解等,题目难度中等,注意把握溶液中守恒关系的应用以及离子浓度大小比较方法,侧重于考查学生的分析能力和对基础知识的综合应用能力.


科目:高中化学 来源: 题型:实验题
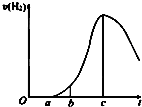 成都七中文艺青年小组进行了关于“活泼金属与酸反应”的实验,得出了一些有趣的想法,请你帮助他们,完成一些判断.将5.4g铝片投入500mL 0.5mol•L-1的硫酸溶液中,如图为反应产氢速率与反应时间的关系图.
成都七中文艺青年小组进行了关于“活泼金属与酸反应”的实验,得出了一些有趣的想法,请你帮助他们,完成一些判断.将5.4g铝片投入500mL 0.5mol•L-1的硫酸溶液中,如图为反应产氢速率与反应时间的关系图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在该反应中,硫元素被氧化 | |
| B. | 上述反应中,Y为氮气 | |
| C. | 红色固体是氧化亚铜 | |
| D. | 98g H2SO4参与反应,必转移0.5NA个电子(NA为阿伏伽德罗常数的值) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光纤通信使用的光缆主要成分是Si,太阳能电池使用的材料主要是SiO2 | |
| B. | 视频《穹顶之下》再次引起公众对“PM2.5”的关注.“PM2.5”是指大气中直径小于或等于2.5×10-6m的细小颗粒物,这些颗粒扩散在空气中形成胶体 | |
| C. | 医用酒精是用淀粉类植物发酵经蒸馏制成,浓度通常是75% | |
| D. | 油脂是人类维持生命活动所需能量的主要来源 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
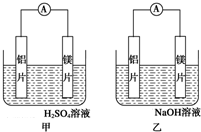 有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6mol•L-1的H2SO4溶液中,乙同学将电极放入6mol•L-1的NaOH溶液中,如图所示.
有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6mol•L-1的H2SO4溶液中,乙同学将电极放入6mol•L-1的NaOH溶液中,如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡时,其他条件不变,增加NH3的浓度,反应速率会降低 | |
| B. | 单位时间内消耗NO和N2的物质的量比为1:2时,反应达到平衡 | |
| C. | 其他条件不变,充入氦气,压强增大,化学反应速率增大 | |
| D. | 平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉的成分为次氯酸钙 | |
| B. | 实验室可用浓硫酸干燥HI气体 | |
| C. | 实验室可用NaOH溶液处理NO2和HCl废气 | |
| D. | Cl2与SO2以等物质的量比同时通入品红溶液,能增强其漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. |  的分子式为C17H24O3 的分子式为C17H24O3 | |
| B. | 结构为…-CH=CH-CH=CH-CH=CH-CH=CH-…的高分子化合物,其单体是乙炔 | |
| C. | 在碱性条件下,CH3CO18OC2H5的水解产物是CH3COOH和C2H518OH | |
| D. | 完全燃烧等质量的甲醛、乙酸、葡糖糖、蔗糖消耗的氧气量相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com