
分析 SO2与氢氧化钠反应都生成Na2SO3,可通过化学方程式的计算得出其质量,SO2与氢氧化钠反应都生成NaHSO3,可通过化学方程式的计算得出其质量,比较极限反应获得固体质量和实际质量之间的关系可以进行讨论,在根据S元素守恒和质量关系计算各自的量的多少即可.
解答 解:若4.48L即0.2mol标况下的SO2与氢氧化钠反应都生成Na2SO3,可通过化学方程式的计算得出其质量,SO2+2NaOH=Na2SO3+H2O,生成Na2SO325.2g,若4.48L即0.2mol标况下的SO2与氢氧化钠反应都生成NaHSO3,SO2+NaOH═NaHSO3,生成的NaHSO3质量为20.8g,所以最后得到的无水晶体不可能是这两种物质形成的混合物,也不可能是其中之一,由此其组成可能是Na2SO3和反应没有完全消耗掉的NaOH,在蒸干过程中,亚硫酸盐会被空气中氧气氧化为硫酸盐,亚硫酸氢盐会被氧化为硫酸氢盐,所以所得晶体还可以是或是亚硫酸钠、硫酸钠的混合物;或是亚硫酸氢钠、硫酸钠的混合物;或是硫酸钠、硫酸氢钠的混合物,若晶体组成是Na2SO3和反应没有完全消耗掉的NaOH此混合物中的氢氧化钠质量为26.8-25.2=1.6g,其物质的量为0.04mol,如果是亚硫酸钠、硫酸钠的混合物,硫酸钠是亚硫酸钠的氧化产物,根据硫元素守恒以及晶体质量之和是26.8g,解得他们各自的物质的量均是0.1mol,同理可得,如果是硫酸钠和亚硫酸氢钠的混合物,物质的量分别是0.042mol、0.158mol,如果是硫酸钠、硫酸氢钠的混合物,物质的量分别是0.127mol、0.073mol,
答:所得所得晶体的成分与物质的量为
$\left\{\begin{array}{l}{n(N{a}_{2}S{O}_{4})=0.20mol}\\{n(NaOH)=0.04mol}\end{array}\right.$,$\left\{\begin{array}{l}{n(N{a}_{2}S{O}_{3})=0.10mol}\\{n(N{a}_{2}S{O}_{4})=0.10mol}\end{array}\right.$,$\left\{\begin{array}{l}{n(NaHS{O}_{3})=0.042mol}\\{n(N{a}_{2}S{O}_{4})=0.158mol}\end{array}\right.$,$\left\{\begin{array}{l}{n(N{a}_{2}S{O}_{4})=0.127mol}\\{n(NaHS{O}_{4})=0.073mol}\end{array}\right.$.
点评 本题是一道关于元素以及化合物的计算题,多种解题思想:元素守恒、极限反应的灵活应用是解题的关键,难度大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
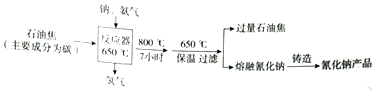

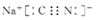 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
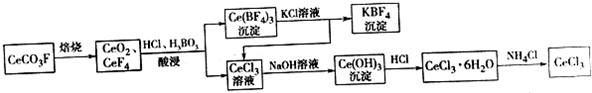
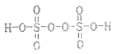 ,其中S元素的化合价为:+6.过硫酸铵(NH4)2Fe(SO4)2溶液将Ce3+氧化Ce4+为的离子方程式为:S2O42-+2Ce3+=2Ce4++2SO42-
,其中S元素的化合价为:+6.过硫酸铵(NH4)2Fe(SO4)2溶液将Ce3+氧化Ce4+为的离子方程式为:S2O42-+2Ce3+=2Ce4++2SO42-查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷和乙烯均可使酸性KMnO4溶液褪色 | |
| B. | 甲烷燃烧会生成CO2,因此不属于清洁能源 | |
| C. | 向甲苯中滴入少量浓溴水,振荡,静置,溶液分层,上层呈橙红色,下层几乎无色,可知甲苯和溴水发生取代反应,使溴水褪色 | |
| D. | 水煤气、裂解气、焦炉气、天然气都是混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
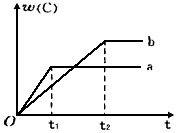 如图表示反应A(g)+B(g)?nC(g);△H<0,在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线.下列有关叙述正确的是( )
如图表示反应A(g)+B(g)?nC(g);△H<0,在不同条件下反应混合物中C的百分含量和反应过程所需时间的关系曲线.下列有关叙述正确的是( )| A. | 反应起始由逆反应开始建立平衡 | |
| B. | a表示有催化剂,b表示无催化剂 | |
| C. | 若n=2,其它条件相同,a比b的压强大 | |
| D. | 若其它条件相同,a比b的温度高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 现象 | 实验结论 | |
| A | 将SO2气体通入紫色石蕊试液中 | 溶液先变红后褪色 | 二氧化硫具有酸性和漂白性 |
| B | 将小苏打和硫酸应生成的气体,通入一定浓度的Na2SiO3溶液中 | 出现白色胶状沉淀 | 酸性:H2SO4>H2CO3>H2SiO3 |
| C | 将光亮的镁条放入盛有NH4Cl溶液的试管中 | 有大量气泡产生 | 反应中有NH3产生 |
| D | 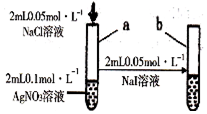 | 试管a出现白色沉淀,试管b出现黄色沉淀 | 溶度积:Ksp(AgCl)>Ksp(AgI) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入足量的NaOH溶液充分振荡后,用分液漏斗分液弃除下层溶液 | |
| B. | 加入溴水,生成三溴苯酚,再过滤除去 | |
| C. | 加水,加热超过 70℃(苯酚在热水中溶解度很大),然后用分液漏斗振荡分液后,弃除下层溶液 | |
| D. | 将混合物蒸馏(甲苯沸点110℃,苯酚沸点182℃),可先蒸出甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同质量的乙烯和甲烷完全燃烧后产生的水的质量相同 | |
| B. | 用溴的四氯化碳溶液或酸性KMnO4溶液都可以鉴别乙烯和乙烷 | |
| C. | 无论乙烯与Br2的加成,还是乙烯使酸性KMnO4溶液褪色,都与分子内含有碳碳双键有关 | |
| D. | 乙烯的化学性质比乙烷的化学性质活泼 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com