
【题目】如图所示,甲池的总反应式为:N2H4+O2=N2+H2O,下列关于该电池工作时的说法正确的是( )

A. 该装置工作时,Ag电极上有气体生成
B. 甲池中负极反应为N2H4-4e-=N2+4H+
C. 甲池和乙池中的溶液的pH均减小
D. 当甲池中消耗0.1molN2H4时,乙池中理论上最多产生6.4g固体
【答案】C
【解析】甲池能自发的发生氧化还原反应而作原电池,通入肼的电极为负极,通入氧气的电极为正极,负极反应为N2H4-4e-+4OH-=N2+4H2O,正极反应为O2+4e-+2H2O=4OH-,乙池为电解池,阴极电极反应为 Cu2++2e-=Cu、阳极反应为4OH--4e-=2H2O+O2↑,A.通入肼的电极为负极,负极与阴极相连,银极为阴极,铜离子得电子生成铜单质,选项A错误;B.甲池负极反应为N2H4-4e-+4OH-=N2+4H2O,氢离子不能在碱性溶液中出现,选项B错误;C.甲池生成水,导致溶液中KOH浓度降低,则溶液pH减小,乙池中氢氧根离子放电,导致溶液pH减小,选项C正确;D.甲池N2H4-4e-+4OH-=N2+4H2O,消耗0.1mol N2H4时,转移0.4mol电子,乙池Cu2++2e-=Cu,产生0.2mol铜,为12.8g固体,选项D错误。答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】现有短周期主族元素X、Y、Z、R、T,R原子的最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Y与T同主族。五种元素原子半径与原子序数之间的关系如图所示。下列推断正确的是( )

A. 离子半径:Y<Z
B. 氢化物的沸点:Y<T
C. 最高价氧化物对应水化物的酸性:T<R
D. 由X、Y、Z、R四种元素组成的常见化合物中含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氧化铁样品中含有少量的硫酸亚铁。某同学要测定其中铁元素的质量分数,设计了如下实验方案。

(1)操作Ⅰ中配制溶液时,所用到的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管以外,还必须有__________(填仪器名称)。
(2)反应①中加入足量H2O2溶液,反应的离子方程式:_______________________________。
(3)检验沉淀中![]() 是否洗涤干净的操作是_______________________________________。
是否洗涤干净的操作是_______________________________________。
(4)将沉淀加热,冷却至室温,用天平称量坩埚与加热后固体的总质量为b1g,再次加热并冷却至室温称其质量为b2g,若b1-b2=0.3,还应进行的操作是_____________________。
(5)坩埚的质量为42.6 g,最终坩埚与加热后的固体的总质量为45.8 g,则样品中铁元素的质量分数为________________。
(6)有同学认为上述方案的实验步骤太繁琐,他认为,只要将样品溶于水充分搅拌,加热、蒸干、灼烧称量即可测得样品中铁元素的质量分数,你认为他的这个方案是否可行?__________(填“可行”或“不可行”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知硼与铝的性质相似,能与氧气、氢氧化钠溶液等物质反应,硼与氯气反应生成三氯化硼(BC13),生成的三氯化硼遇水水解产生白雾(已知:BC13的熔点为 -107. 3℃,沸点为12.5 ℃)。某兴趣小组设计如图所示装置制备三氯化硼。
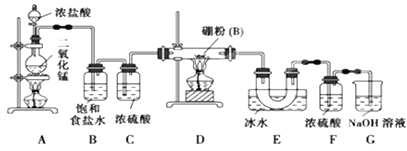
回答下列问题:
(1)写出装置A中发生反应的离子方程式________________。
(2)写出装置D中发生反应的化学方程式为_____________________。
(3)装置B、E的作用分别是________________、________________。
(4)可以用盛装____________(填试剂名称)的干燥管代替装置F和G,使实验更简便。
(5)为了顺利完成实验,点燃酒精灯的正确操作是______(填字母),
a.先点燃A处酒精灯,后点燃D处酒精灯
b.先点燃D处酒精灯,后点燃A处酒精灯
c.同时点燃A、D两处酒精灯
其理由是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物:

下列说法正确的是( )
A.正四面体烷的分子式为C4H8B.正四面体烷二氯取代产物有1种
C.环辛四烯核磁共振氢谱有2组峰D.环辛四烯与苯互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于某有机物![]() 的性质叙述正确的是( )
的性质叙述正确的是( )
A. 1 mol该有机物可以与3 mol Na发生反应
B. 1 mol该有机物可以与3 mol NaOH发生反应
C. 1 mol该有机物可以与6 mol H2发生加成反应
D. 1 mol该有机物分别与足量Na或NaHCO3反应,产生的气体在相同条件下体积相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组用海带为原料制取少量碘。其实验操作可分解为如下几步
A.将海带灼烧成灰
B.______________
C.使用新制氯水置换出碘单质,反应方程式:Cl2+2KI=2KCl+I2
D. 萃取
E.得到固体碘
回答下列问题
(1)写出步骤A中需要的仪器_______。
(2)步骤B的实验操作名称_________。
(3)步骤D中向分液漏斗中加入苯作萃取剂后,如何操作可使两种溶液充分接触,_______;碘进入______层液体,颜色为________。
(4)步骤E中得到固体碘,还需要的仪器为______。
A.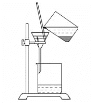 B.
B.![]() C.
C.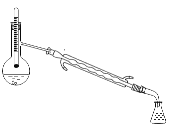 D.
D. 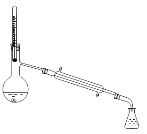
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种杀菌消毒效率高、二次污染小的水处理剂。实验室中可通过以下反应制得:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O。下列说法不正确的是( )
A.CO2是氧化产物
B.H2C2O4在反应中被氧化
C.H2C2O4的氧化性强于ClO2的氧化性
D.ClO2作水处理剂时,利用了其强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型锂电池正极材料锰酸锂(LiMn2O4)有望取代广泛使用的LiCoO2。工业上用某软锰矿(主要成分为MnO2,还含有少量铁、铝及硅等氧化物)为原料制备锰酸锂的流程如图:
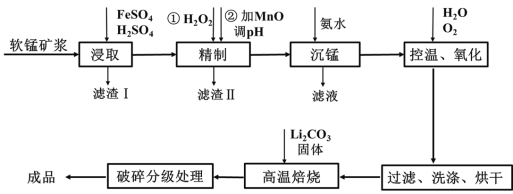
已知: lg2=0.3,![]() =8,25℃有关物质的溶度积常数:
=8,25℃有关物质的溶度积常数:
物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
Ksp | 8.0×10-16 | 4.0×l0-38 | 5.12×10-33 | 4.0×l0-14 |
(1)已知锂电池放电时正极的电极反应式为:LiMn2O4+e-+Li+ ===Li2Mn2O4,则锰酸锂中锰元素的化合价为____。
(2)“浸取”得到的浸取液中阳离子主要是Mn2+,生成Mn2+的离子方程式为_____,检验还含有Fe2+的方法是______。
(3)“精制”中加入H2O2的量比理论值大的多,其主要原因是______,若所得溶液中锰离子的浓度为1 mol·L-1,则加入氧化锰调节pH的范围为____(当溶液中离子浓度小于10-5 mol·L-1时可以认为沉淀完全)。
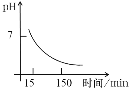
(4)“沉锰”得到的是Mn(OH)2和Mn2(OH)2SO4滤饼,二者均可被氧化为Mn3O4,若控温氧化时溶液的pH随时间的变化如下图,则15~150 min内滤饼中一定参加反应的成分是______;判断的理由是____(用化学方程式表示)。
(5)写出高温煅烧生成锰酸锂的化学方程式_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com