
下列结论不正确的是
A.粒子半径:S>S2->Cl- B.酸性:HClO4>H2SO4>H3PO4
C.金属性:Na>Mg>Al D.氢化物稳定性:HF>H2O>NH3
科目:高中化学 来源:2013-2014浙江省下学期第二次统练高二化学试卷(解析版) 题型:选择题
下列有关作用力的说法正确的是
A.金属键、离子键、分子间作用力都没有方向性和饱和性
B.键能、金属的原子化热、晶格能分别可以衡量氢键、金属键、离子键的强弱
C.离子键、金属键、氢键、范德华力本质上都是静电作用
D.乙酸、丙醇、丙酮的沸点都比丁烷高是因为前三者分子间都存在氢键
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江省五校高三第二次联考理综化学试卷(解析版) 题型:填空题
(14分)为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下:

部分含钒物质在水中的溶解性如下:
物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
回答下列问题:
⑴工业由V2O5冶炼金属钒常用铝热剂法,写出该反应的化学方程式 。
⑵滤液中含钒的主要成分为 (写化学式)。
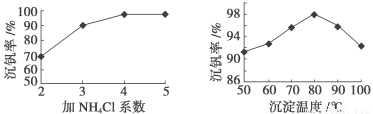
⑶该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,该步反应的离子方程式 ;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图判断最佳控制氯化铵系数和温度为 、 。
⑷用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,反应的离子方程式为□VO2+ +□H2C2O4+□_____ =□VO2++□CO2↑+□H2O,试将其配平。
⑸全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为VO2+ +V2++2H+  VO2++H2O+V3+,电池充电时阳极的电极反应式为 。
VO2++H2O+V3+,电池充电时阳极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江宁波市下学期期末全市(八校)联考高一化学试卷(解析版) 题型:选择题
下表为部分短周期元素化合价及其相应原子半径的数据。下列说法正确的是
元素性质 | 元素编号 | |||||||
A | B | C | D | E | F | G | H | |
原子半径(nm) | 0.102 | 0.117 | 0.074 | 0.110 | 0.071 | 0.075 | 0.077 | 0.099 |
最高化合价 | +6 | +4 |
| +5 |
| +5 | +4 | +7 |
最低化合价 | -2 | -4 | -2 | -3 | -1 | -3 | -4 | -1 |
A.C为硫元素
B.A、B是同周期元素
C.F、H的简单离子的电子层结构相同
D.元素G在周期中的位置是第二周期第Ⅳ族
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江宁波市下学期期末全市(八校)联考高一化学试卷(解析版) 题型:选择题
下列除杂或鉴别的方法不可行的是
A.用Br2水可鉴别苯与乙醇
B.将混合气体通过灼热的铜网除去N2中的少量O2
C.用KMnO4溶液除去乙烯中的乙炔
D.用适量HNO3除去NaNO3溶液中少量的Na2CO3
查看答案和解析>>
科目:高中化学 来源:2013-2014浙江宁波市下学期期末全市(八校)联考高一化学试卷(解析版) 题型:选择题
核磁共振技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域。已知只有质子数或中子数为奇数的原子核才有此性质。下列原子可产生核磁共振现象的是
A.18O B.28Si C.32SD.40K
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省高二下学期期中考试化学试卷(解析版) 题型:选择题
165℃、1×105Pa下,两气态有机物以任意比例混合,1L该混合物与9LO2混合,充分燃烧后所得气体体积仍为10L,下列各组混合烃中符合此条件的是( )
A.CH4、C2H6 B.CH4、C3H6 C.CH3OH、C3H4 D.CH4、C3H4
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省豫东、豫北十所名校高三阶段性测试理综化学试卷(解析版) 题型:填空题
(15分)
M、N、O、P、Q是元素周期表中原子序数依次递增的前四周期元素。M原子最外层电子数为内层电子数的3倍;N的焰色反应呈黄色;O的氢化物是一种强酸,其浓溶液可与M、Q的化合物反应生成O的单质;P是一种金属元素,其基态原子中有6个未成对电子。请回答下列问题:
(1)元素Q的名称为__________,P的基态原子价层电子排布式为__________ 。
(2)O的氢化物的沸点比其上一周期同族元素的氢化物低,是因为__________________________.
(3)M、O电负性大小顺序是__________(用元素符号表示),O的最高价含氧酸根的空间构型为__________,其中心原子的杂化类型为___________。
(4)M、N形成的化合物的晶胞如图所示,该晶胞的化学式为__________ ,其中M离子的配位数为__________,该晶体类型为___________。
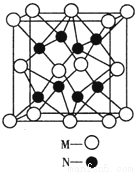
(5)该晶胞的边长为a×10 cm,则距离最近的M、N离子间的距离为
cm,则距离最近的M、N离子间的距离为
__________cm。
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省濮阳市高三第二次模拟考试理综化学试卷(解析版) 题型:简答题
水是一种重要的自然资源,是人类赖以生存不可缺少的物质。水质优劣直接影响人体健康。请回答下列问题:
(l)天然水中溶解的气体主要有____、____ ______(填化学式)。
(2)检验蒸馏水的纯度时,最简单易行的方法是测定水的____。
(3)水的净化与软化的区别是:水的净化是用混凝剂(如明矾等)使____,而水的软化是 。
(4)通过施加一定压力使水分子透过半透膜而将大分子或离子截留,从而使水得以净化的方法称为____;电渗析法净化水时,使离子通过半透膜的推动力是____。
(5)某天然水中。c(Ca2+)=1.2×10-3mol/L,c(Mg2+)=6×10-4mol/L,c(HCO3-)=8×10-4mol/L,
要软化10  这种天然水,需先加入Ca(OH)2_______g,再加入Na2CO3_______g。
这种天然水,需先加入Ca(OH)2_______g,再加入Na2CO3_______g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com