
科目:高中化学 来源: 题型:
| A、哈伯法合成氨是吸热反应,新法合成氨是放热反应 |
| B、新法合成氨不需要在高温条件下,可节约大量能源,具有发展前景 |
| C、新法合成氨能在常温下进行是因为不需要断裂化学键 |
| D、新催化剂降低了反应所需要的能量,使平衡正向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、14.2g | B、4.24g |
| C、11.44 | D、无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
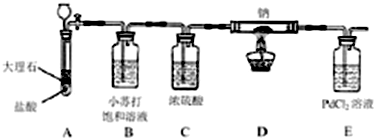
| 序号 | 实验操作 | 实验现象 | 结论 |
| 1 | 待反应完全后,将装置D中的残留固体加蒸馏水溶解. | 有黑色不溶物 | |
| 2 | 取①所得溶液上层清液加入过量BaCl2溶液 | 产物中有Na2CO3存在 | |
| 3 | - | 产物中有CO存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该反应的氧化剂是MnO4- |
| B、该反应右边方框内的产物是OH- |
| C、该反应电子转移总数是5e- |
| D、配平该反应后,H+的系数是16 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 27℃ | 2000℃ |
| K值 | 3.84×10-31 | 0.1 |
| 温度 | 25℃ | 350℃ | 400℃ | 450℃ |
| K值 | 5×108 | 1.847 | 0.507 | 0.152 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com