
【题目】下列有机物命名正确的是( )
A. ![]() 2—乙基丙烷 B.
2—乙基丙烷 B. ![]() 2—戊炔
2—戊炔
C. ![]() 间二甲苯 D.
间二甲苯 D. ![]() 2—甲基—2—丙烯
2—甲基—2—丙烯
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】向含Fe2+、I、Br的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知ba=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素。下列说法正确的是
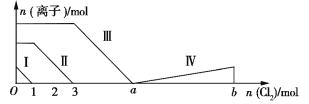
A. 线段Ⅱ表示Br的变化情况
B. 原溶液中n(FeI2)∶n(FeBr2)=3∶1
C. 根据图象无法计算a的值
D. 线段Ⅳ表示![]() 的变化情况
的变化情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务,如图是海水综合利用的一个方面。
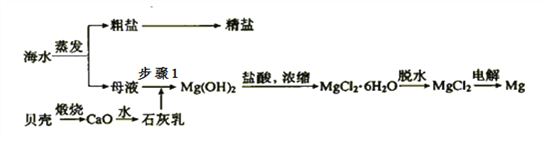
Ⅰ.(1)上述过程中没有涉及到的四大基本反应类型是 ______;
a.化合反应 b.分解反应 c.置换反应 d.复分解反应
(2)步骤1中分离操作的名称是___________;
(3)粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用试剂为:
a.盐酸 b.BaCl2溶液 c.NaOH溶液 d.Na2CO3溶液
加入试剂的顺序是_____________;
II.实验室利用精盐配制480mL 2.0mol·L1NaCl溶液。
(4)除容量瓶外,还需要的玻璃仪器有___________________;
(5)用托盘天平称取固体NaCl________g;
(6)配制时,按以下几个步骤进行:①计算 ②称量 ③溶解 ④冷却 ⑤转移 ⑥定容 ⑦摇匀 ⑧装瓶。操作中还缺少一个重要步骤是______________________;
(7)下列错误操作可使所配制氯化钠溶液浓度偏低的是(_________)
a.容量瓶洗净后残留了部分的水
b.转移时溶液溅到容量瓶外面
c.定容时俯视容量瓶的刻度线
d.摇匀后见液面下降,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧铅蓄电池经粗加工可得到铅膏,其主要成分为PbO、PbO2、PbSO4等。以铅膏为原料回收PbSO4,流程如下:
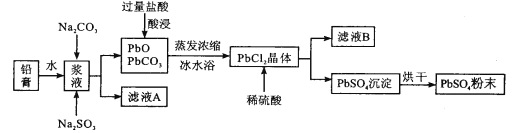
已知:PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq)ΔH>0
PbCl42-(aq)ΔH>0
(1)用Na2CO3作转化剂,将铅膏中的硫酸铅转化为碳酸铅,其离子方程式为_______。
(2)浆液中加入Na2SO3溶液的目的是________。
(3)从滤液A提取Na2SO4·10H2O晶体,主要步骤为______、______、过滤、洗涤、干燥;上述流程中可循环利用的物质是_________(写化学式)。
(4)采用冰水浴得PbCl2晶体的原因是________。
(5)理论上要得到a吨的PbSO4,则铅膏的质量范围为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl为白色粉末,微溶于水,溶于浓盐酸或NaCl浓溶液,不溶于乙醇。一种由海绵铜(Cu和少量CuO等)为原料制备CuCl的工艺流程如下:
(1)“溶解浸取”时,下列措施不能提高铜的浸取率的是__________(填序号)。
a.将海绵铜粉末与水搅拌成浆液 b.投料时,NaNO3适当过量
c.缩短浸取时间 d.将滤渣1返回再次溶解浸取
(2)“还原,氯化”时,Na2SO3和NaCl的用量对CuCl产率的影响如图-1、图-2所示:
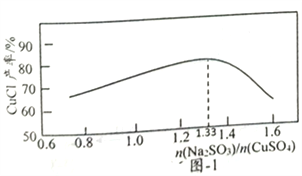

①CuSO4与Na2SO3、NaCl在溶液中反应生成CuCl的离了方程式为__________。
②当n(Na2SO3)/n(CuSO4)>1.33时,比值越大CuCl产率越小,其原因是__________。
③当1.0<n(NaCl)/n(CuSO4)<1.5时,比值越大CuCl产率越大,其原因是__________。
(3)“过滤2”所得滤液中溶质的主要成分为__________(填化学式)。
(4)用“醇洗”可快速去除滤渣表面的水,防止滤渣被空气氧化为Cu2(OH)3Cl。CuCl被氧化为Cu2(OH)3Cl的化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是
A. 1mol/L的NaCl溶液中含有NA个Na+和NA个Cl-
B. 常温常压下,32g的O2和O3混合气体中含有的分子数为2NA
C. 由“CO(g)+2H2(g) ![]() CH3OH(g) ΔH=-129.0kJ/mol”可知:因为该反应是可逆反应,所以每消耗2NA个H2分子时反应放出的热量小于129.0 kJ
CH3OH(g) ΔH=-129.0kJ/mol”可知:因为该反应是可逆反应,所以每消耗2NA个H2分子时反应放出的热量小于129.0 kJ
D. 1L 0.1 mol/L (NH4)2SO4溶液中含N原子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.二氧化硅分子由1个硅原子和2个氧原子构成
B.二氧化硅和晶体硅都是良好的半导体材料
C.玛瑙和红宝石的主要成分都是二氧化硅
D.二氧化硅属于酸性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中正确的是
A. CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 、△S>0
B. N2(g)+3H2(g)![]() 2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大
2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大
C. 水解反应NH4++H2O![]() NH3·H2O+H+达到平衡后,升高温度平衡向正反应方向移动
NH3·H2O+H+达到平衡后,升高温度平衡向正反应方向移动
D. 水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应是一类重要的反应,在工农业生产、日常生活中都有广泛的用途。
(1)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲。黑火药在发生爆炸时,发生如下反应:2KNO3+3C+S=K2S+N2↑+3CO2↑。其中被氧化的元素是____________,还原产物是____________。
(2)实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为4CuI+Hg=Cu2HgI4+2Cu。
①上述反应产物Cu2HgI4中,Cu元素显________价。
②以上反应中的氧化剂为________,当有1 mol CuI参与反应时,转移电子________mol。
③标明上述反应电子转移的方向和数目______________________________。
(3)工业上常用酸性高锰酸钾溶液处理含有CuS和Cu2S的矿物,其反应原理如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2↑+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2↑+6Mn2++14H2O
根据上述反应原理,某学习小组用400 mL 0.075 mol·L-1的酸性高锰酸钾溶液处理2 g含有CuS和Cu2S的混合物。反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1的(NH4)2Fe(SO4)2溶液完全反应。
①配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
______MnO4-+______Fe2++______H+=______Mn2++______Fe3++______H2O。
②KMnO4溶液与固体混合物反应后,剩余KMnO4的物质的量为________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com