
【题目】下列物质中,物质的量最大的是__________,含分子个数最多的是__________,含原子个数最多的是__________,质量最大的是__________。(填编号)
A.6 g H2;
B.0.5 mol CO2;
C.148 g H2SO4;
D.4 ℃时18mL水
【答案】A;A;C;C
【解析】
试题分析:A、6g H2的物质的量为![]() =3mol,n(原子)=3mol×2=6mol;B、0.5mol CO2,其质量为0.5mol×44g/mol=44g,n(原子)=0.5mol×3=1.5mol;C、148g H2SO4的物质的量为
=3mol,n(原子)=3mol×2=6mol;B、0.5mol CO2,其质量为0.5mol×44g/mol=44g,n(原子)=0.5mol×3=1.5mol;C、148g H2SO4的物质的量为![]() =1.5mol,n(原子)=1.5mol×7=10.5mol;D、水的质量为18mL×1g/mL=18g,水的物质的量为
=1.5mol,n(原子)=1.5mol×7=10.5mol;D、水的质量为18mL×1g/mL=18g,水的物质的量为![]() =1mol,n(原子)=1mol×3=3mol;故物质的量最大的是:6g H2;含分子个数最多的是:6g H2;含原子个数最多的是:148g H2SO4;质量最大的是:148g H2SO4,故答案为:A;A;C;C。
=1mol,n(原子)=1mol×3=3mol;故物质的量最大的是:6g H2;含分子个数最多的是:6g H2;含原子个数最多的是:148g H2SO4;质量最大的是:148g H2SO4,故答案为:A;A;C;C。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】在一体积固定为10L的密闭恒温容器中充入1.5mol氨气,发生反应:2NH3(g)![]() N2(g)+3H2(g) △H=93KJ/mol
N2(g)+3H2(g) △H=93KJ/mol
反应容器中NH3物质的量随时间的变化如下图所示:

(1)2min时反应进入化学平衡状态,此时容器内物质浓度c(H2)=______mol/L。
(2)0~2min内以NH3表示的平均反应速率v(NH3)=________mol/(L·min)。
(3)依图中曲线判断、0~2min内NH3分解反应是_____(填“先快后慢”或“先慢后快”或“匀速进行”)。
(4)容器内起始时与平衡时的压强比为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇分子中化学键如图所示,对乙醇在各种反应中应断裂的键说明不正确的是( )

A.和金属钠作用时,键①断裂
B.燃烧是全部化学键都断裂
C.在铜催化下和氧气反应时,键①和③断裂
D.和乙酸、浓硫酸共热时,键②断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,22.4LCl2和HCl的混合气体所含分子总数为2NA
B.常温常压下,18 g H2O中含有的原子总数为3 NA
C.标准状况下,11.2 L CH3CH2OH中含有的分子数目为0.5 NA
D.1 L 0.1 mol/L NaOH溶液含有阴阳离子总数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由乙烯推测丙烯(CH2=CHCH3)的结构或性质不正确的是( )
A.能使溴水褪色
B.与HCl在一定条件下加成只得到一种产物
C.最多有7个原子在同一平面上
D.在空气中燃烧时火焰明亮并伴有黑烟
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学研究发现,苹果含有微量元素Zn,而锌是构成与记忆力息息相关的核酸和蛋白质不可缺少的元素。儿童缺锌就会导致大脑发育不良,因此苹果又被称为记忆之果。这说明无机盐离子
A. 对维持酸碱平衡有重要作用
B. 对维持细胞形态有重要作用
C. 对调节细胞内的渗透压有重要作用
D. 对维持生物体的生命活动有重要作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,10 mL 0.40 mol·L-1 H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。下列叙述不正确的是(溶液体积变化忽略不计)( )
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
A.0~6 min的平均反应速率:v(H2O2)≈3.3×10-2mol·(L·min)-1
B.6~10 min的平均反应速率:v(H2O2)<3.3×10-2mol·(L·min)-1
C.反应至6 min时,c(H2O2)=0.30 mol·L-1
D.反应至6 min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸锂广泛应用于陶瓷和医药等领域,以锂辉石(主要成分为LiAlSi2O6)为原材料制备Li2CO3的工艺流程如下:
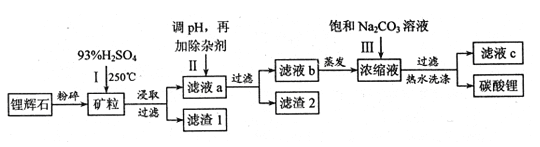
已知①2LiAlSi2O6+H2SO4![]() Li2SO4+Al2O34SiO2H2O
Li2SO4+Al2O34SiO2H2O
②Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、4.7、9.0和11.1
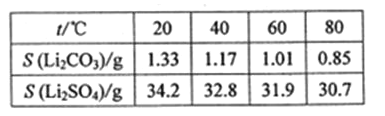
③某些物质的溶解度(S)如下表
请回答下列问题:
(1)锂辉石用浓硫酸浸取之前要粉碎成细颗粒的目的是 。
(2)滤液a中含有Li+、SO42-,另含有Fe3+、Al3+、Fe2+、 Mg2+ 、Ca2+ 、Na+等杂质,步骤Ⅱ需在搅拌下加入石灰石以调节溶液的pH到6.0—6.5,此时沉淀的杂质离子有 ;石灰石调节溶液pH的原理的离子方程式为 。
(3)步骤Ⅱ在滤液a中加入的除杂剂依次为适量的H2O2溶液,石灰乳和Na2CO3溶液,发生氧化还原反应的离子方程式为 。
(4)步骤Ⅲ中加入饱和Na2CO3溶液过滤后需要用热水洗涤的原因是 。
(5)从滤液c中可回收的主要物质是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com