
| A. | NH4Cl溶液、NaOH溶液、浓H2SO4 | B. | 饱和氨水 | ||
| C. | NaOH溶液、NH4Cl晶体、浓H2SO4 | D. | NH4Cl固体、碱石灰、氢氧化钙 |
分析 实验室用氯化铵和消石灰反应制备氨气,氨气为碱性气体,易溶于水,不能用溶液制备氨气,干燥氨气应用碱性或中性干燥剂.
解答 解:A.氨气易溶于水,不能用溶液制备氨气,氨气为碱性气体,不能用浓硫酸干燥,故A错误;
B.饱和氨水得到的氨气中含有水蒸气,故B错误;
C.氨气易溶于水,不能用溶液制备氨气,氨气为碱性气体,不能用浓硫酸干燥,故C错误;
D.实验室用氯化铵和消石灰反应制备氨气,氨气为碱性气体,可用碱石灰干燥,故D正确.
故选D.
点评 本题考查氨气的制备和干燥,侧重于氨气性质的考查,较为基础,难度不大,实验室制备氨气可用氯化铵和消石灰反应,也可用浓氨水和碱石灰或氢氧化钠固体制备.


 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源: 题型:选择题
| A. | ④<⑤<①<②<③ | B. | ⑤<④<③<②<① | C. | ①<②<④<③<⑤ | D. | ①<②<③<④<⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 血红素是血红蛋白分子上的主要稳定结构,为血红蛋白、肌红蛋白的辅基,其分子结构如图.
血红素是血红蛋白分子上的主要稳定结构,为血红蛋白、肌红蛋白的辅基,其分子结构如图. )中有3个手性碳原子.
)中有3个手性碳原子.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

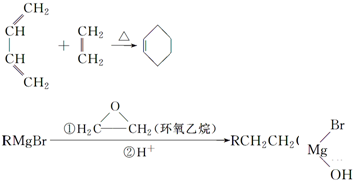
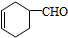 ,A中所含官能团的名称是醛基、碳碳双键.
,A中所含官能团的名称是醛基、碳碳双键.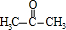 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ②③ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
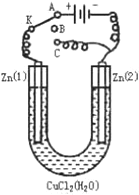 在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,按如图连接:
在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,按如图连接:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
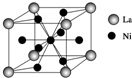 开发新型储氢材料是氢能利用的重要研究方向.
开发新型储氢材料是氢能利用的重要研究方向.| I1 | I2 | I3 | I4 | I5 | |
| I/kJ•mol-1 | 738 | 1 451 | 7 733 | 10 540 | 13 630 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在化合物中呈现+2价 | B. | 氢氧化物呈强碱性 | ||
| C. | 单质与冷水不反应 | D. | 碳酸盐难溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com