
【题目】下列各组物质中,第―种是酸,第二种是混合物,第三种是碱的是
A. 硫酸、CuSO4 ·5H2O、苛性钾 B. 硫酸、冰水混合物、烧碱
C. 硝酸、食盐水、苛性钠 D. 盐酸、蔗糖水、生石灰
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.芳香烃是指具有香味的有机化合物
B.含有苯环的有机物一定是芳香烃
C.芳香烃分子中一定含有苯环
D.含有一个苯环的芳香烃一定是苯的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 和
和 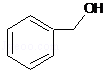 分子组成相差一个﹣CH2﹣,因此是同系物关系
分子组成相差一个﹣CH2﹣,因此是同系物关系
B.![]() 和
和 ![]() 均是芳香烃,
均是芳香烃, ![]() 既是芳香烃又是芳香族化合物
既是芳香烃又是芳香族化合物
C.分子式为C4H8的有机物可能存在4个C﹣C单键
D.分子式为C2H6O的红外光谱图上发现有C﹣H键和C﹣O键的振动吸收,由此可以初步推测:有机物结构简式一定为C2H5﹣OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为测定碘盐中KIO3的质量分数并制备少量KIO3 , 进行了如下实验. I.测定加碘盐中KIO3的质量分数(杂质不发生反应)
已知:KIO3+3H2SO4+5KI=3I2+3K2CO3+3H2O; I2+2Na2S2O3=2Na I+Na 2S4O6
步骤一:准确称取a g加碘盐,配制成250mL溶液;
步骤二:取所配溶液25.00mL于锥形瓶中,加稀硫酸酸化,再加入足量KI溶液;
步骤三:以淀粉为指示剂,用c molL﹣1的Na2S2O3溶液滴定步骤二所得溶液至终点,记录数据;重复滴定2次,平均消耗Na2S2O3溶液12.00mL.
(1)步骤一中配制250mL溶液用到的玻璃仪器除烧杯、玻璃棒和量筒外,还有 .
(2)步骤三中到达滴定终点时的现象为 .
(3)实验测得此加碘盐中KIO3的质量分数 .
(4)Ⅱ.实验室制备KIO3已知:碘酸盐可以用氯气在碱性溶液中氧化碘化物得到.该化学小组通过以下装置制备KIO3 . 
装置A中反应的离子方程式为 .
(5)装置B中的试剂为 .
(6)写出装置C中生成KIO3的离子方程式 .
(7)上述实验装置存在一处明显缺陷,请指出 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将A与B的混合气体分别置于恒压容器甲和恒容容器乙中,发生反应:2A(g) + 2B(g)![]() 3C(g) ΔH<0。下列说法不正确的是
3C(g) ΔH<0。下列说法不正确的是
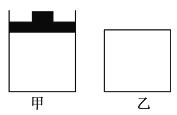
A.在相同条件下两容器内的反应均达到化学平衡状态,升温时甲、乙两容器中反应速率均增大
B.在相同条件下两容器内的反应均达到化学平衡状态,升温时甲、乙两容器中的平衡均向逆反应方向移动
C.在相同温度下,甲容器中加入2 mol A和2 mol B,乙容器中加入2 mol A和2 mol B,若甲容器中反应经30 s达到平衡状态,则乙容器中反应达到平衡所需要的时间也是30 s
D.在相同的温度和压强下,用甲容器分别进行如下反应。第一次加入2 mol A和2 mol B;第二次加入2 mol A、2 mol B和3 mol C;第三次加入4 mol C。分别达到化学平衡状态时,C的物质的量百分含量分别为X、Y、Z,则X、Y、Z的大小关系是X=Y=Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“张﹣烯炔环异构反应”可高效构筑五元环化合物:  (R、R‘、R“表示氢、烷基或芳基)
(R、R‘、R“表示氢、烷基或芳基)
合成五元环有机化合物J的路线如图:
已知: ![]()
(1)A的结构简式是 .
(2)B、C 含有相同的官能团,D 中含有的官能团是 .
(3)E与溴水反应生成F的化学方程式是;试剂a 是 .
(4)顺式结构的CH2CH=CHCH2OH和G反应生成H(顺式结构)的化学方程式为 .
(5)某芳香族化合物N的相对分子质量比E的相对分子质量大2,N能与NaHCO3溶液反应放出气体,则N的同分异构体有种(不考虑立体异构);其中核磁共振氢谱为5组峰,且峰面积比为2:1:2:2:3的结构简式是(写出一种即可).
(6)参照上述合成信息,设计一条由 ![]() 和CH3CHO为原料合成
和CH3CHO为原料合成 ![]() 的合成路线流程图: . (其它试剂任选,合成路线常用的表示方式为:CH3CH2OH
的合成路线流程图: . (其它试剂任选,合成路线常用的表示方式为:CH3CH2OH ![]() CH2=CH2
CH2=CH2 ![]()
![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AB2)=4.2×10﹣8 , Ksp(AC)=3.0×10﹣15 . 在AB2、AC均为饱和的混合液中,测得c(B﹣)=1.6×10﹣3 molL﹣1 , 则溶液中c(C2﹣)为( )
A.1.8×10﹣13 molL﹣1
B.7.3×10﹣13 molL﹣1
C.2.3 molL﹣1
D.3.7 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中排放的NxOy和CO,科学家寻找高效催化剂实现大气污染物转化: 2CO(g)+2NO(g)N2(g)+2CO2(g)△H1
(1)已知:CO的燃烧热△H2=﹣283kJmoL﹣1 . 几种化学键的键能数据如下:
化学键 | N≡N键 | O=O键 | N |
键能kJ/mol﹣1 | 945 | 498 | 630 |
已知:N2(g)+O2(g)=2NO(g)△H3 , 则:△H1= .
(2)CO与空气在KOH溶液中构成燃料电池(石墨为电极),若放电后电解质溶液中离子浓度大小顺序为 c(K+)>c(HCO3﹣)>c(OH﹣)>c(H+)>c(CO32﹣),则负极的反应式为;
(3)在一定温度下,向2L的密闭容器中充入4.0molNO2和4.0molCO,在催化剂作用下发生反应 4CO(g)+2NO2(g)N2(g)+4CO2(g)△H<0,相关数据如下:
0min | 5min | 10min | 15min | 20min | |
c(NO2) | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
c(N2) | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
①5~10min,用CO的浓度变化表示的反应速率为:
②能说明上述反应达到平衡状态的是
A.2n正(NO2)=n逆(N2) B.混合气体的平均相对分子质量不变
C.气体密度不变D.容器内气体压强不变
③20min时,向容器中加入1.0molNO2和1.0molCO,在t1时刻再次达到平衡时,NO2的转化率比原平衡时(填“变大”、“变小”或“不变”).
④计算此温度下的化学平衡常数K=
⑤在上述平衡的基础上,在时间t2、t3时改变反应的某一条件,反应速率的变化如图所示,则在t3时刻改变的反应条件是:;在时间15﹣20,t1﹣t2 , t2﹣t3 , t4﹣t5时的平衡常数分别为K1、K2、K3、K4 , 请比较各平衡常数的大小关系: . 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com