
【题目】铼(Re)是种银白色的重金属,是地球地壳中最稀有的元素之一,它广泛应用于航空航天领域。在工业上,高温灼烧含ReS2的矿粉,可以制备Re2O7。另一种途径是从炼铜的废液中提取铼,其简易工艺流程如图(部分副产物省略,铼在废液中以ReO4-形式存在)。下列说法错误的是( )
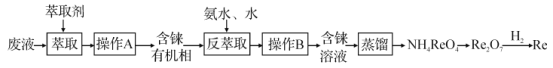
A.在“反萃取”中,加入氨水、水的目的是萃取有机层中的ReO4-
B.在NH4ReO4制备Re2O7的过程中,产生的副产物可回收利用
C.实验室在H2还原Re2O7的过程中,一共消耗7 mol H2,则可制得2 mol Re
D.以含ReS2的矿石原料生产48.4 t Re2O7,理论上转移电子3.0×106 mol
【答案】C
【解析】
A.在“反萃取”中,加入氨水、水可反应产生NH4ReO4,以达到萃取有机层中的ReO4-,A正确;
B.NH4ReO4不稳定,受热分解产生Re2O7,反应方程式为:NH4ReO4 ![]() Re2O7+2NH3↑+H2O,反应产生的副产物NH3可用于反萃取,提取有机物中的ReO4-,因而可以达到回收利用的目的,B正确;
Re2O7+2NH3↑+H2O,反应产生的副产物NH3可用于反萃取,提取有机物中的ReO4-,因而可以达到回收利用的目的,B正确;
C.实验室在H2还原Re2O7的过程中,H2除作还原剂外,还作保护气,在实验前要先通入H2排除装置中的空气,反应结束后要进一步通入H2,使制取得到的Re在H2的还原性环境中冷却,防止Re被热的空气氧化,因此若共消耗7 mol H2,则制得Re 是物质的量小于 2 mol,C错误;
D.工业上,高温灼烧含ReS2的矿粉,可以制备Re2O7,涉及反应为4ReS2+15O2![]() 2Re2O7+8SO2,则生成1 mol Re2O7,转移30 mol电子,48.4 t Re2O7的物质的量为n(Re2O7)=
2Re2O7+8SO2,则生成1 mol Re2O7,转移30 mol电子,48.4 t Re2O7的物质的量为n(Re2O7)=![]() mol=1.0×105 mol,则反应转移电子的物质的量n(e-)=1.0×105 mol×30=3.0×106 mol,D正确;
mol=1.0×105 mol,则反应转移电子的物质的量n(e-)=1.0×105 mol×30=3.0×106 mol,D正确;
故合理选项是C。


 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】常温下,用一定浓度的盐酸溶液滴定某氨水溶液。滴定终点附近溶液pH和导电能力的变化分别如下图所示(利用溶液导电能力的变化可判断滴定终点,溶液总体积变化忽略不计)。下列说法错误的是
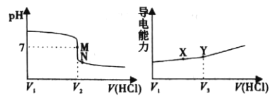
A.M点对应溶液中c(NH4+)=c(Cl-)
B.X→Y溶液导电性增强的主要原因是c(H+)和c(Cl-)增大
C.根据溶液pH和导电能力的变化可判断V2<V3
D.M→N过程中 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自2020年7月1日起,在全国范围内实行轻型汽车国Ⅵ排放标准,该标准对氮氧化物、碳氢化物(HC)、一氧化碳和悬浮粒子等排放物的限制将更为严苛。
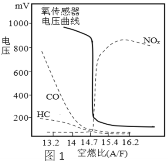
(1)空燃比(A/F:空气质量与燃油质量之比)对尾气排放、发动机动力等都有很大影响。利用氧传感器测定可找到最佳空燃比区域(曲线如图1)。由图可知最佳空燃比区域为___附近,理由是________。推广使用无铅汽油的优点是____________。
(2)汽车尾气通过三元催化装置净化的原理是:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H1
2CO2(g)+N2(g) △H1
已知:① N2(g)+O2(g)=2NO(g) △H2
② C(s)+O2(g)=CO2(g) △H3
③ C(s)+![]() O2(g)=CO(g) △H4
O2(g)=CO(g) △H4
则△H1=_______(用含△H2、△H3、△H4的关系式表示)。
(3)选择性催化还原技术(SCR)利用氨或尿素将NOx还原为N2和H2O,原理是:NO(g)+NO2(g)+2NH3(g) ![]() 3H2O(g)+2N2(g) △H
3H2O(g)+2N2(g) △H
①其他条件不变时,NO的转化率与温度、压强的关系如图2所示。则△H_____0,p1 ____ p2(填“>”或“<”)。
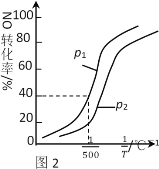
②在500℃时,2L密闭容器中充入1molNO、1molNO2和2molNH3,达平衡时压强为p1MPa。则500℃时该反应的平衡常数Kp=_______。
(4)汽车尾气中还存在NH3等,含氮化合物广泛应用于化工、化肥、制药等领域。
①已知N2H4在水溶液中的一级电离方程式为N2H4H2O![]() +OH-,则
+OH-,则![]() 的电子式为________________。
的电子式为________________。
②已知:Ag+(aq) +2NH3(aq)[Ag(NH3)2]+(aq),其平衡常数表达式为Kf =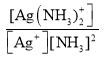 =1.7×107,Ksp(AgCl)=1.7×10-10。用1Lc molL-1的氨水可溶解0.1mol AgCl(s) (假设溶液体积仍为1L),则该氨水的最小浓度c=_____molL-1(保留三位有效数字,提示:
=1.7×107,Ksp(AgCl)=1.7×10-10。用1Lc molL-1的氨水可溶解0.1mol AgCl(s) (假设溶液体积仍为1L),则该氨水的最小浓度c=_____molL-1(保留三位有效数字,提示:![]() ≈3.16)。
≈3.16)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饮用水的质量关系到关系到每个人的健康,因含有一定浓度的NO3-将对人类健康产生危害,NO3-能氧化人体血红蛋白中的Fe(II),使其失去携氧功能,为了降低饮用水中NO3-的浓度,某兴趣小组提出如图方案:
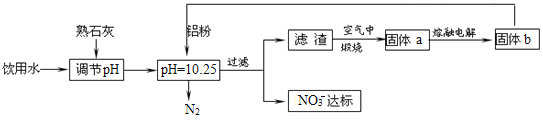
请回答下列问题:
(1)人体血液中如果缺乏亚铁离子,就会造成缺铁性贫血。市场出售的某种麦片中含有微量、颗粒细小的还原铁粉,这些铁粉在人体胃酸(胃酸的主要成分是HCl)作用下转化成亚铁盐。写出该反应的离子方程式:____。
(2)已知过滤后得到的滤渣是一种混合物,则在溶液中铝粉和NO3-反应的离子方程式为__。
(3)该方案中选用熟石灰调节pH,理由是___、___。
(4)用H2催化还原法也可降低饮用水中NO3-的浓度,已知反应中的还原产物和氧化产物均可参与大气循环,则催化还原法的离子方程式为___。
(5)饮用水中的NO3-主要来自于NH4+。已知在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如图,试写出1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式是____。
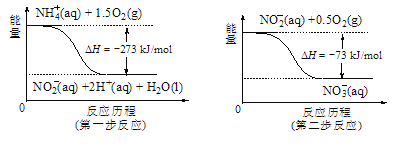
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下.某同学进行CO2与Na2O2反应的探究实验(本实验所涉及气体休积均在相同状况下测定)。请回答下列问题:
(1)用下图装置制备纯净的CO2.
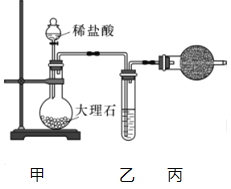
①丙装置的名称是_______,乙装置中盛装的试剂是_______.
②若CO2中混有HCl,则HCl与Na2O2发生反应的化学方程式为_________。
(2)按下图所示装置进行实验(夹持装置略)。
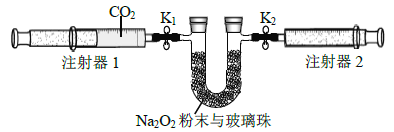
①先组装仪器.然后________.再用注射器1抽取100 mL纯净的CO2,将其连接在K1处,注射器2的活塞推到底后连接在K2处,具支U形管中装入足量的Na2O2粉末与玻璃珠。
②打开止水夹K1、K2,向右推动注射器1的活塞。可观察到的现象是________。
③实验过程中.需缓慢推入CO2,其目的是__________.为达到相同目的,还可进行的操作是__________________________。
(3)实验结束后,当注射器1的活塞推到底时,测得注射器2中气体的体积为65 mL。则CO2的转化率是_______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制氢和储氢作为氢能利用的关键技术,是当前科学家主要关注的热点问题。一定条件下,如图所示装置可实现有机物的电化学储氢(除目标产物外,近似认为无其他有机物生成)。电流效率=(生成目标产物消耗的电子数/转移的电子总数)×100%,则下列说法错误的是( )
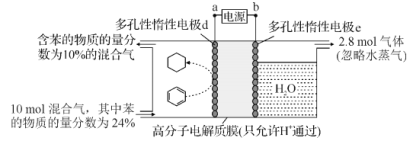
A.电子移动方向为:a→d;e→b
B.d电极反应式为C6H6+6H++6e-=C6H12
C.该储氢装置的电流效率明显小于100%,其原因可能是除目标产物外,还有H2生成
D.由图中数据可知,此装置的电流效率约为32.1%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如下图所示。下列分析不正确的是
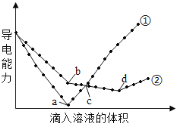
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH-
C.a、d两点对应的溶液均显中性
D.c点,两溶液中含有相同物质的量的OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.NH4HCO3溶于过量的浓KOH溶液中:HCO![]() +2OH-=CO
+2OH-=CO![]() + H2O
+ H2O
B.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO![]() 沉淀完全:2Al3++3SO
沉淀完全:2Al3++3SO![]() +3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
C.向FeBr2溶液中通入足量氯气:2Fe2++2Br-+2Cl2=2 Fe3++Br2+4 Cl-
D.向氢氧化铁中加入HI溶液:2Fe(OH)3+6H+ +2I—= 2Fe2+ + I2 +6 H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com