
����Ŀ����Դ����ϡ���Ϣһ�𱻳�Ϊ�ִ���ᷢչ������֧���������Դ�ݽߵ�Σ���������Դ�����ʺͿ�������Դ�ǽ����һ�����������Ҫ����
(1)��ѧ��Ӧ���ʺ���������������������أ����ǻ�ѧѧ�ƹ�ע�ķ���֮һ��ijͬѧΪ��̽��п�����ᷴӦ�����е����ʱ仯���� 400mL ϡ�����м���������п�ۣ�����ˮ���ռ���Ӧ�ų���������ʵ���¼����(�ۼ�ֵ):
ʱ��/min | 1 | 2 | 3 | 4 | 5 |
�������/mL(���) | 100 | 240 | 464 | 576 | 620 |
����һ��ʱ���ڷ�Ӧ�������____min(����0��1������1��2������2��3������3��4�� ����4��5��)��
����һѧ��Ϊ���Ʒ�Ӧ���ʷ�ֹ��Ӧ�������Բ�������������������������м���������������Һ�Լ�����Ӧ���ʵ���Ӱ��������������������Ϊ���е���____(����ĸ���)��
A.KCl ��Һ B.Ũ���� C.����ˮ D.CuSO4 ��Һ
(2)��ͼΪԭ���װ��ʾ��ͼ��
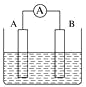
���� A Ϊ����B Ϊþ�������Ϊϡ������Һ����������_______(������Ƭ������þƬ��)��
����AΪCu��B Ϊʯī�������Ϊ FeCl3 ��Һ������ʱ���ܷ�ӦΪ 2FeCl3+Cu=2FeCl2+CuCl2��д��ͭ�缫�ĵ缫��Ӧʽ��____�����õ�ط�Ӧ������ 0.1mol FeCl3�� ��ת�Ƶ��ӵ���ĿΪ _____��
���𰸡�2��3 AC þƬ Cu-2e-=Cu2+ 0.1NA
��������
(1)����Ӧ����Խ�죬��ͬʱ�����ռ�������Խ�ࣻ
��Ҫ���ͷ�Ӧ���ʣ����Բ��ý���������Ũ�ȵķ���ʵ�֣�
(2)������Ƭ��þƬ�õ��������������Ϊϡ������Һ��þ�������ã�þ��������
����AΪͭƬ��BΪʯī�������ΪFeCl3��Һ��Cuʧ������������ʯī��������������ͭʧ��������ͭ���ӡ�ʹ����Cu��������С�������������ӵõ��������������ӣ���ϵ缫��Ӧʽ����ת�Ƶ�����Ŀ��
(1)����ͬ�����£���Ӧ����Խ����ͬʱ�����ռ�������Խ�࣬0��1 min�ռ�����100 mL��1��2 min�ռ�����140 mL��2��3 min�ռ�����224 mL��3��4 min�ռ�����112 mL��4��5 min�ռ�����44 mL���ɴ˿ɼ���2��3 min�ռ����������࣬��2��3 minʱ���ڷ�Ӧ�������
��A������KCl��Һ��ʹ��Һ��c(H+)���ͣ���Ӧ���ʽ��ͣ��������������ʵ������䣬���������������䣬A�������⣻
B������Ũ������Һ��ʹ��Һ��c(H+)����ѧ��Ӧ���������������������ʵ������ӣ�ʹ����������������B���������⣻
C����������ˮ��ʹ��Һ��c(H+)��С����Ӧ���ʽ��ͣ��������������ʵ������䣬���������������䣬C�������⣻
D������CuSO4��Һ��Zn��ͭ���ӷ����û���Ӧ����Cu��Zn���û�������Cu��ϡ���ṹ����ԭ��ض��ӿ췴Ӧ���ʣ�D���������⣻
�ʺ���ѡ����AC��
(2)���� A Ϊ����B Ϊþ�������Ϊϡ������Һ����þ�������ã���������þƬ��
����AΪCu��B Ϊʯī�������Ϊ FeCl3 ��Һ������ʱ���ܷ�ӦΪ 2FeCl3+Cu=2FeCl2+CuCl2�����ݷ���ʽ��֪��CuΪ������Cuʧ��������ͭ���ӣ�ͭ�缫�ĵ缫��ӦʽΪCu-2e-=Cu2+���������ϣ���Һ�е�Fe3+�õ�������Fe2+��������B�ĵ缫��ӦʽΪFe3++e-=Fe2+�����������ĵ缫��Ӧʽ��֪�����õ�ط�Ӧ������ 0.1mol FeCl3ʱ��ת�Ƶ��ӵ����ʵ���Ϊ0.1mol����ĿΪ0.1NA��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С�����ü״�ȼ�ϵ�ؽ������µ��ʵ�飬���м׳ص��ܷ�ӦʽΪ2CH3OH+3O2+4KOH=2K2CO3+6H2O������˵������ȷ����

A. �׳���ͨ��CH3OH�ĵ缫��Ӧ��CH3OH-6e-+8OH-=CO32-+6H2O
B. �׳�������560mLO2����״���£��������ҳ�Ag�缫����3.2g
C. ��Ӧһ��ʱ������ҳ��м���һ����Cu(OH)2���壬��ʹCuSO4��Һ�ָ���ԭŨ��
D. �����Ҳ�Pt�缫�ĵ缫��Ӧʽ��Mg2++2H2O+2e-=Mg(OH)2��+H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��B��[ʵ�黯ѧ]
��Ȳ�������![]() ����һ����Ҫ���л�����ԭ�ϣ��е�Ϊ103~105 �档ʵ�����Ʊ�������Ȳ������ķ�ӦΪ
����һ����Ҫ���л�����ԭ�ϣ��е�Ϊ103~105 �档ʵ�����Ʊ�������Ȳ������ķ�ӦΪ
![]()
ʵ�鲽�����£�
����1���ڷ�Ӧƿ�У�����14 g��Ȳ�ᡢ50 mL�״���2 mLŨ���ᣬ���裬���Ȼ���һ��ʱ�䡣
����2�����������ļ״���װ�ü���ͼ����
����3����ӦҺ��ȴ�������ñ���NaCl��Һ��5%Na2CO3��Һ��ˮϴ�ӡ�������л��ࡣ
����4���л��ྭ��ˮNa2SO4������ˡ����ñ�Ȳ�������

��1������1�У���������״���Ŀ����________��
��2������2�У���ͼ��ʾ��װ��������A��������______��������ƿ�м������Ƭ��Ŀ����______��
��3������3�У���5%Na2CO3��Һϴ�ӣ���Ҫ��ȥ��������____��������л���IJ�������Ϊ____��
��4������4�У�����ʱ������ˮԡ���ȵ�ԭ����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���黯��(GaAs)������������ͨ���ݵ�100���������ܼ�Ϊ10%���ƹ��黯��(GaAs)�� ������(GaN)�ȷ�������ܣ�LED���������ǽ��ܼ��ŵ���Ч�ٴ롣��ش��������⣺
(1)��̬Nԭ�Ӻ�������Ų�ͼΪ _____________________ ��Ga��Alͬ���壬��λ��Al����һ���ڣ����̬Gaԭ�ӵļ۵����Ų�ʽΪ ________________��
(2)Ga�ĵ縺�Ա�As______��������������С������Ga��ʧȥ���ӵĵ����� ����λ��kJ��mol-1������ֵ����Ϊ577��1985��2962��6192���ɴ˿���֪Ga����Ҫ���ϼ�Ϊ__��+3��
(3)�Ƚ�����Ga��±������۵�ͷе㣬 GaCl3��GaBr3��GaI3���ۡ��е���������, ������仯��ԭ���ǣ�_____________________________________________________��
�ص�±���� | GaCl3 | GaBr3 | GaI3 |
�۵�/�� | 77.75 | 122.3 | 211.5 |
�е�/�� | 201.2 | 279 | 346 |
GaF3���۵㳬��1000�棬���ܵ�ԭ����____________________________��
(4)GaAs�ǽ�(CH3)3Ga��AsH3�ý����л��ﻯѧ������������Ʊ��õ����÷�Ӧ��700���½���
����÷�Ӧ�Ļ�ѧ����ʽΪ��____________________________________________��
�ڷ�Ӧ��AsH3���ӵļ��ι���Ϊ________________��(CH3)3Ga����ԭ���ӻ���ʽΪ____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�صĻ�̬ԭ�ӵĺ��������3������״̬��5�ֿռ�״̬��X�����е�һ��������С��Ԫ�أ�Ԫ��Y��M������˶�״̬��X�ļ۵����˶�״̬��ͬ��Ԫ��Zλ�ڵ������ڣ����̬ԭ�ӵ�2��������M����ȫ���������ӡ�
(1)X��̬ԭ�ӵĵ����Ų�ʽΪ___________��
(2)X���⻯��(H2X)���Ҵ��е��ܽ�ȴ���H2Y����ԭ����___________��
(3)��Y���⻯��(H2Y�����У�Yԭ�ӹ�����ӻ�������___________��
(4)Y��X���γ�YX32����
��YX32�������幹��Ϊ___________(����������)��
��д��һ����YX32����Ϊ�ȵ�����ķ��ӵĻ�ѧʽ___________��
(5)Z���Ȼ����백ˮ��Ӧ���γ������[Z(NH3)4(H2O)2]Cl2������������ʱ������ʧȥ�������е�������___________(д��ѧʽ)��

(6)Y��Z���γɻ����ᄃ��ľ�����ͼ��ʾ���û�����Ļ�ѧʽΪ___________���侧���߳�Ϊ540.0pm���ܶ�Ϊ___________g��cm��3(��ʽ������)��aλ��Y��bλ��Z֮��ľ���Ϊ___________pm(��ʽ��ʾ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȼ�շ��Dzⶨ�л������ʽ��һ����Ҫ��������ȫȼ�� 0.1mol ij��������ɵĶ�����̼Ϊ 11.2 L(��״��)�����ɵ�ˮΪ 10.8g��������������գ�
(1)�����ķ���ʽΪ_________��
(2)д�������ܴ��ڵ�ȫ�����ʵĵĽṹ��ʽ ��_________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A(C6H6O)��һ����Ҫ�Ļ���ԭ�ϣ��㷺����������֬��ҽҩ�ȡ�
����A��BΪԭ�Ϻϳɱ���������F��·�����¡�
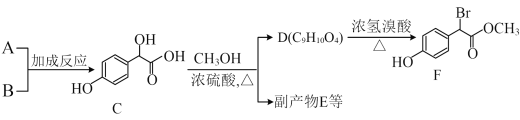
(1)A��������____��B�Ľṹ��ʽ��____��
(2)C(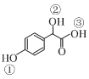 )�Т١����ǻ���ԭ�ӵĻ�����ǿ������˳����____��
)�Т١����ǻ���ԭ�ӵĻ�����ǿ������˳����____��
(3)D�Ľṹ��ʽ��____��
(4)д��F�����NaOH��Һ��Ӧ�Ļ�ѧ����ʽ��___________��
(5)��E�����к���3����Ԫ������E�Ľṹ��ʽ��________��
����AΪԭ�Ϻϳ���Ҫ��ҽҩ�м���K��·�����¡�
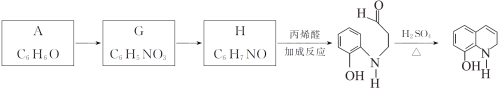
(6)G��H�ķ�Ӧ������__________��
(7)һ�������£�K��G��Ӧ���� ��H��ˮ����ѧ����ʽ��__________��
��H��ˮ����ѧ����ʽ��__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Һ���Ǹ������ʣ������ܵ��������塣����˵������ȷ����(����)
A. NH3�����е�ԭ�ӵ��ӻ���ʽΪsp3�ӻ�
B. [Cu(NH3)4]2����NH3����������
C. ��ͬѹǿ�£�NH3�ķе��PH3�ķе��
D. NH4+��PH4+��CH4��BH4-��Ϊ�ȵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2S��SO2��Ի��������彡�����������Σ������ҵ�ϲ�ȡ���ַ���������Щ�к�������ŷţ��ش����и������е����⡣
��H2S�ij�ȥ
����1��������H2S��ԭ��Ϊ��
H2S+Fe2(SO4)3![]() S��+2FeSO4+H2SO4
S��+2FeSO4+H2SO4
4FeSO4+O2+2H2SO4![]() 2Fe2(SO4)3+2H2O
2Fe2(SO4)3+2H2O
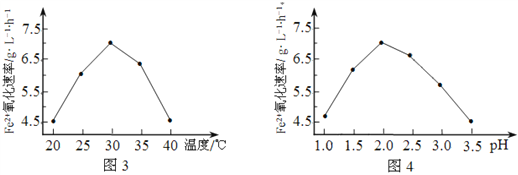
��1����˾�����ʱ��FeSO4����������������ʱ��5��105�����þ���������______________��
��2����ͼ3��ͼ4�ж�ʹ����˾����������Ϊ______________������Ӧ�¶ȹ��ߣ���Ӧ�����½�����ԭ����______________��
����2����һ�������£���H2O2����H2S
��3�����Ųμӷ�Ӧ��n(H2O2)/n(H2S)�仯���������ﲻͬ����n(H2O2)/n(H2S)=4ʱ����������ķ���ʽΪ__________��
��SO2�ij�ȥ
����1��˫�������NaOH����SO2������CaOʹNaOH����
NaOH��Һ![]() Na2SO3
Na2SO3
��4��д�����̢ٵ����ӷ���ʽ��____________________________��CaO��ˮ�д�������ת����
CaO(s)+H2O (l) ![]() Ca(OH)2(s)
Ca(OH)2(s)![]() Ca2+(aq)+2OH(aq)
Ca2+(aq)+2OH(aq)
��ƽ���ƶ��ĽǶȣ��������̢�NaOH������ԭ��____________________________________��
����2���ð�ˮ��ȥSO2
��5����֪25�棬NH3��H2O��Kb=1.8��105��H2SO3��Ka1=1.3��102��Ka2=6.2��108������ˮ��Ũ��Ϊ2.0 mol��L-1����Һ�е�c(OH)=_________________mol��L1����SO2ͨ��ð�ˮ�У���c(OH)����1.0��107 mol��L1ʱ����Һ�е�c(![]() )/c(
)/c(![]() )=___________________��
)=___________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com