
| A. | 用渗析的方法制制氢氧化铁胶体 | |
| B. | SiO2、NaCl、I2、C2H6O均能真实表示物质分子组成 | |
| C. | ${\;}_{8}^{18}$O2-离子结构示意图 | |
| D. | 冰酸酸、铝热剂、硫酸钡、SO2分别屈于酸、混合物、强电解质、非电解质 |
分析 A.氢氧化铁胶体不能透过半透膜;
B.由分子构成的物质,化学式可表示真实的分子;
C.O2-离子原子核外有10个电子,最外层电子数为8;
D.硫酸钡为强酸强碱盐,难溶于水,但溶于水的部分完全电离.
解答 解:A.氢氧化铁胶体不能透过半透膜,则用渗析的方法精制氢氧化铁胶体,故A正确;
B.二氧化硅为原子晶体,由原子构成,NaCl为离子晶体,由离子构成,不存在分子,故B错误;
C.O2-离子原子核外有10个电子,最外层电子数为8,离子结构示意图为 ,故C正确;
,故C正确;
D.硫酸钡为强酸强碱盐,难溶于水,但溶于水的部分完全电离,为强电解质,故D正确.
故选B.
点评 本题考查内容较多,为高频考点,涉及胶体、晶体类型、原子结构示意图以及物质的分类等知识,注意明确强弱电解质的概念,试题培养了学生灵活应用所学知识的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 工业上用二氧化硅在高温下与焦炭反应,生成单质硅和二氧化碳的原理,制取粗硅 | |
| B. | 手指不慎被玻璃划伤流血,可向伤口上涂FeCl3溶液,是因为FeCl3溶液可杀菌消毒 | |
| C. | 2014年山东莱芜共出现284天雾霾天气,对煤进行液化和气化等物理变化的处理,可减少雾霾天气的发生 | |
| D. | 白酒放置一定时间香味更浓,是因为白酒中乙醇与少量的有机酸反应生成有香味的酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
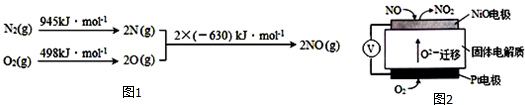
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
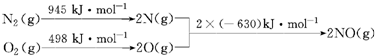
| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2(g)+3H2(g) $?_{高温高压}^{催化剂}$2NH3(g)△H=-93 kJ•mol-1 | |
| B. | N2(g)+3H2(g) $?_{高温高压}^{催化剂}$2NH3(g)△H=+1471 kJ•mol-1 | |
| C. | N2(g)+3H2(g) $?_{高温高压}^{催化剂}$2NH3(g)△H=+93 kJ•mol-1 | |
| D. | N2(g)+3H2(g) $?_{高温高压}^{催化剂}$2NH3(g)△H=-1471 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用瓷坩埚熔融氢氧化钠或碳酸钠 | |
| B. | 用玻璃棒蘸取溶液,点在湿润的pH试纸上测定溶液的pH值 | |
| C. | 用NaOH溶液洗涤并灼烧铂丝后,再进行焰色反应 | |
| D. | 读取量筒内溶液液体的体积,俯视读数导致读数偏大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液体均一,呈紫红色 | |
| B. | 液体分两层,上层为紫红色,下层为无色 | |
| C. | 液体分两层,上层为无色,下层为紫红色 | |
| D. | 液体均一,呈无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
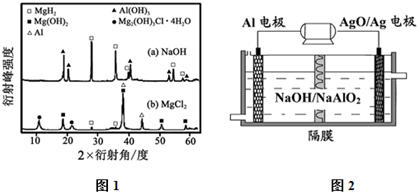
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{100w}{w+18a}$% | B. | $\frac{7100w}{161(w+18a)}$% | C. | $\frac{100w}{w+36a}$% | D. | $\frac{7100w}{161(w+36a)}$% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com